
二氧化钛是钛的重要化合物,钛白粉(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料.从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:
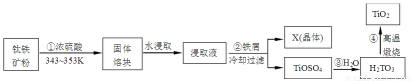
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为: .
(2)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在 离子(填写离子符号),检验溶液中还存在Fe2+的方法是 (写明步骤、试剂和现象).
(3)浸取液与铁屑反应的离子方程式为 ;X(晶体)的化学式为 .
(4)第③步反应化学方程式 .
(1)FeTiO3+2H2SO4=FeSO4+ TiOSO4+ 2H2O.
(2)Fe3+;取少量溶液,滴加少量高锰酸钾溶液,高锰酸钾溶液褪色.或取少量溶液,滴加K3[Fe(SCN)6]溶液,出现蓝色沉淀.
(3)2Fe3++ Fe =3Fe2+;FeSO4·7H2O.
(4)TiOSO4+ 2H2O = H2TiO3+H2SO4.
【解析】
试题分析:(1)根据提示:钛铁矿主要成分FeTiO3与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为:FeTiO3+2H2SO4=FeSO4+ TiOSO4+ 2H2O.(2)实验中一般用KSCN溶液检验Fe3+;若Fe3+、Fe2+共存时检验Fe2+,一般利用Fe2+的还原性,用酸性高锰酸钾溶液检验;或取少量溶液,滴加K3[Fe(SCN)6]溶液,出现蓝色沉淀.(3)根据反应流程判断钛的产物没有改变,加入铁是与Fe3+反应生成Fe2+,阴离子是硫酸根离子,所以X为FeSO4·7H2O;(4)第③步操作为TiOSO4与水反应生成H2TiO3,应为水解反应,TiOSO4+ 2H2O = H2TiO3+H2SO4.
考点:物质的制备与检验.


科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:填空题
(14分)砷(As)广泛分布于自然界,其原子结构示意图是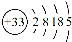 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
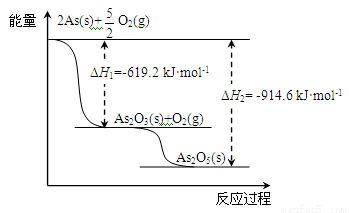
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+  AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
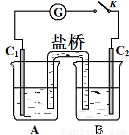
① A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3
的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针
向右偏转。此时C2上发生的电极反应是 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH
溶液,可观察到电流计指针 (填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。As2O5与NaOH溶液反应的离子方程式是 。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
如图中的两条线分别代表的是:1 g C3H6 和1 g M气体在相同容 积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体可能是( )
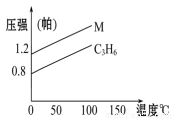
A.C3H8 B.C2H4
C.H2S D.N2O4
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
下列说法中,正确的有( )
(1)明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
(2)氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
(3)氨常用作制冷剂,是因为其沸点极低,很容易液化
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
(6)通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
(7)铝粉和氧化镁粉末混合,高温能发生铝热反应
(8)高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
(9)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性
(10)同主族元素的简单阴离子还原性越强,水解程度越大
(11)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(12)在硫酸铜结晶水含量测定实验中,至少要用天平称量三次质量
(13)将水蒸汽通过灼热的铁粉,粉末变红,说明铁在高温条件下可与水发生化学反应
(14)先取少量试液于试管中,再加入氢氧化钠溶液,将润湿的红色石蕊试纸放在试管口,红色石蕊试纸不变蓝,证明溶液中不含铵根离子。
(15)已知次磷酸(H3PO2)是一元中强酸,则NaH2PO2是正盐
A.8句 B.6句 C.5句 D.7句
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
下列各种溶液中通入足量的SO2后,既无沉淀又无气体产生的有_________种 ( )
①Ba(OH)2 ②Ba(NO3)2 ③Na2S ④BaCl2 ⑤Ca(ClO)2
⑥Fe(NO3)3 ⑦H2O2 ⑧NaClO ⑨C6H5ONa
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液.
不正确的操作顺序是
A.⑤②④①③ B.④②⑤①③
C.②⑤④①③ D.⑤④②①③
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为统一类物质,下列分类标准正确的是
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质 ④电解质 ⑤钠盐 ⑥钠的含氧化合物
A.①③④⑤ B.①②⑤⑥ C.①③④ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+CO2→2Na2CO3+O2 B.2Na2O2+2SO3→2Na2SO4+O2
C.Na2O2+H2SO4→Na2SO4+H2O2 D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
已知氧元素有16O、18O两种核素,按中学化学知识要求,下列说法正确的是
A.Na2O2与H218O反应时生成产生18O2气体
B.向2SO2(g) +O2(g)  2SO3(g)的平衡体系中加入18O2,结果18O2只出现在产物中
2SO3(g)的平衡体系中加入18O2,结果18O2只出现在产物中
C.CH3COOH和CH3CH218OH发生酯化反应时,产物中分子式为H218O
D.惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com