
| A. | 透明的溶液中:Al3+、Cu2+、SO42-、NO3- | |
| B. | 通入SO2的溶液中:Fe3+、Ba2+、Cl-、NO3- | |
| C. | 加入铝粉产生H2的溶液中:NH4+、Fe3+、SO42-、NO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol/L:K+、Ba2+、Cl-、NO3- |
分析 A.该组离子之间不反应;
B.SO2与Fe3+发生氧化还原反应;
C.加入铝粉产生H2的溶液,为非氧化性酸或强碱溶液;
D.常温下,由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.SO2与Fe3+发生氧化还原反应,生成的硫酸根离子与Ba2+结合生成沉淀,不能大量共存,故B错误;
C.加入铝粉产生H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在NH4+、Fe3+,酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故C错误;
D.常温下,由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液,酸、碱溶液中该组离子之间不反应,可大量共存,故D正确;
故选AD.
点评 本题考查离子的共存,为高频考点,把握习题中的信息、常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | S8转化为S6、S4、S2属于物理变化 | |
| B. | 不论哪种硫分子,完全燃烧时都生成SO3 | |
| C. | S8分子中硫原子的杂化方式是sp3杂化 | |
| D. | 把硫单质在空气中加热到750℃即得S2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
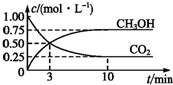 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当金属全部溶解时,无法计算出参与反应的硝酸的物质的量 | |
| B. | 7.2<m<19.2 | |
| C. | 当金属全部溶解时,收集到NO气体的体积一定为4.48L | |
| D. | 当生成沉淀的量达到最大值时,消耗NaOH溶液的体积为120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4 | B. | NaClO | C. | Ca(ClO)2 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液和溴水因发生化学反应而褪色 | |
| B. | 不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 | |
| C. | 配制银氨时,应将大量浓氨水一次性加入到少量硝酸银溶液中 | |
| D. | 用银氨溶液或新制氢氧化铜来检验醛或酮时,均只需要水浴加热 | |
| E. | 配制氢氧化铜悬浊液时,应将少量硫酸铜溶液加入到过量的氢氧化钠溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
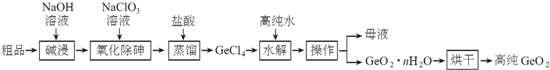
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3 | B. | CH2=CH-CH2-CH2-CH3 | ||
| C. | CH2=CH-CH2-CH=CH2 | D. | CH2=CH-CH2-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com