
| A. | 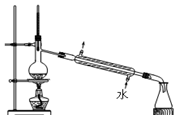 制蒸馏水 | B. | 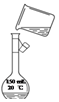 转移溶液 | ||
| C. | 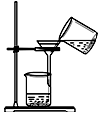 过滤 | D. | 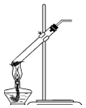 分解NaHCO3固体 |
分析 A.蒸馏法可制备蒸馏水,温度计测定馏分的温度,冷水下进上出;
B.转移液体需要引流;
C.过滤需要引流;
D.碳酸氢钠分解生成碳酸钠、水、二氧化碳.
解答 解:A.蒸馏法可制备蒸馏水,温度计测定馏分的温度,冷水下进上出,图中蒸馏装置合理,故A正确;
B.转移液体需要引流,图中缺少玻璃棒,故B错误;
C.过滤需要引流,图中缺少玻璃棒,故C错误;
D.碳酸氢钠分解生成碳酸钠、水、二氧化碳,为防止生成的水倒流,试管口应略向下倾斜,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有的Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com