
分析 (1)根据m(溶质)=m(溶液)×ω计算溶质的质量,计算混合后溶液的质量,利用混合后溶质的质量等于原不同浓度溶液中氯化钠的质量之和计算混合后溶质氢氧化质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算混合液的物质的量浓度;
(3)令需要氯化钠的物质的量为nmol,根据m=nM计算NaCl的质量,利用质量分数相等列方程计算.
解答 解:(1)将20.0g14%的NaCl溶液跟30.0g24%的NaCl溶液混合,混合后溶液的质量为20g+30g=50g,
令混合后NaCl的质量分数为ω,则:50g×ω=20g×14%+30g×24%,
解得ω=20%,故答案为:20%;
(2)混合后溶液中NaCl的物质的量浓度为$\frac{1000×1.17×20%}{58.5}$mol/L=4.0mol/L,
故答案为:4.0mol/L;
(3)令需要氯化钠的物质的量为n mol,NaCl的质量为n mol×58.5g/mol=58.5g,则:$\frac{58.5n}{1000+58.5n}$=20%,
解得n=4.27mol,
故答案为:4.27.
点评 本题考查物质的量浓度、质量分数的有关计算,难度中等,注意对公式的理解与灵活运用,③中计算利用质量分数比利用物质的量浓度解答简单,注意体会.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法可以除去食盐水中的泥沙 | |
| B. | 酒精灯加热烧瓶时不用垫石棉网 | |
| C. | 氯化氢气体能使干燥的蓝色石蕊试纸变红 | |
| D. | 盛放氢氧化钠溶液的玻璃瓶,可以使用橡胶塞或玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨气化时要吸收大量的热,可用作制冷剂 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | SO2具有氧化性,可用于漂白纸浆 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
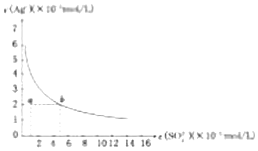
| A. | 在SO42-浓度为3mol/L的溶液中肯定不存在Ag+ | |
| B. | 0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | 在任何存在Ag2SO4的悬浊溶度积中c(Ag+)=2c(SO42-) | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③ | C. | ①②③⑤ | D. | 全部正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com