

分析 (1)分离固体与液体混合物应用过滤;依据碘单质易溶于有机溶剂,结合萃取分液操作解答;
(2)选用的萃取剂的原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂;
(3)依据分液操作用到的仪器解答;
(4)蒸馏实验中蒸馏烧瓶加热应垫石棉网;温度计测定温度为蒸汽的温度;为达到最佳冷凝效果冷凝水与蒸汽流向相反,据此解答;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点;
(6)四氯化碳是无色液体;苯密度比水小,在上层,下层为KCl溶液.
解答 解:(1)分离固体和液体用过滤,③将碘水中的碘单质萃取出来,选择合适的萃取剂即可,故答案为:过滤; 萃取;
(2)提取碘的过程中为萃取,萃取剂选择原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,
A.苯与水互不相溶,碘在苯中溶解度远远大于水中,故A选;
B.四氯化碳与水互不相溶,碘在四氯化碳中溶解度远远大于水中,故B选;
C.酒精与水互溶,不能萃取碘水中的碘,故C不选;
故选:AB;
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,应进行萃取分液操作,分液操作用到的仪器:分液漏斗、玻璃棒、烧杯、铁架台(带铁夹),所以还缺少的主要仪器为分液漏斗;
故答案为:分液漏斗;
(4)烧杯受热要垫石棉网,增大受热面积;冷凝水应是下进上出,冷凝水的方向错误,应为下进上出;温度计水银球的位置错误,温度计水银球应与烧瓶支管口相平;
故答案为:加热时没有垫石棉网;温度计位置错误;冷凝水进出口方向错误;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,
故答案为:受热均匀,温度较低容易控制;
(6)四氯化碳是无色液体;已知2KI+Cl2═2KCl+I2,故碘单质被萃取后水溶液里主要是KCl溶液,苯的密度比水的小,故苯萃取碘后在上层,呈紫红色,KCl在下层,无色,
故答案为:无;紫红色或紫色; KCl.
点评 本题考查海水资源的综合利用,为高频考点,主要是海水提碘,侧重考查物质的检验、混合物的分离和提纯,明确常见混合物分离和提纯方法及其选取方法是解本题关键,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
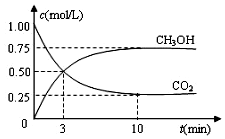 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示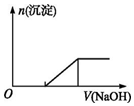 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com