
【题目】用NA表示阿伏伽德罗常数的数值,则下列说法中正确的是( )
A.44gCO2所含质子数为44NA个
B.常温常压,11.2L氧气含原子数为NA个
C.2.3g钠变为离子失电子数0.1NA
D.常温常压下,NA个氢原子的质量为2g
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
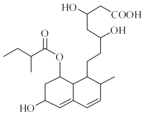
A. 能与FeCl3 溶液发生显色反应
B. 能使酸性KMnO4 溶液褪色,不能使溴水褪色
C. 能发生加成、取代、消去、氧化、还原反应
D. 1mol 该物质最多可与1mol NaOH 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
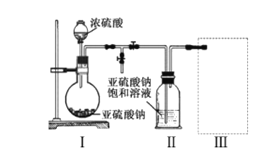
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。 装置II中有Na2S2O5晶体析出,发生的反应为: Na2SO3+SO2=Na2S2O5
(1)装置1中产生气体的化学方程式为_____________________
(2)要从装置II 中获得已析出的晶体,可采取的分离方法是_____________________
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号)。

实验二 焦亚硫酸钠的性质
已知: Na2S2O5 易被氧化,溶于水即生成NaHSO3
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________________。
(5)设计实验证明NaHSO3溶液中HSO3-的电离程度大于水解程度___________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。则定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,滴定终点的现象是______________________________。滴定时消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________kg/L。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果____________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列说法正确的是
A.光纤通信所使用的光缆的主要成分是晶体Si,太阳能电池使用的常用材料主要是SiO2
B.我国重点城市近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物
C.太阳光透过树叶间的缝隙射入密林中的光柱的形成属于丁达尔效应
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是__________________。
(2)三颈烧瓶的容量为____________(填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗具有特殊的结构,主要目的是__________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_________。然后加入精制食盐使之变成饱和溶液,其目的是________。再将混合液倒入分液漏斗中,分离得到有机层。
(5)有机层先加无水MgSO4,用如上右图对粗产品进行精制,加入无水MgSO4的作用是_____。检验精制后的坏己酮是否纯净,可使用的试剂为________________。
A.重铬酸钾溶液B.金属钠C.酚酞溶液 D.新制的氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行可逆反应:2NO2(g)![]() 2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
A. 混合气体的颜色不再改变 B. 混合气体的密度不再改变
C. 混合气体的压强不再改变 D. 混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.H2O的摩尔质量为18g
B.3.01×1023个SO2分子的质量为32g
C.标准状况下,1 mol任何物质体积均为22.4L
D.将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com