

 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________;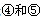 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)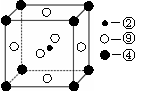
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
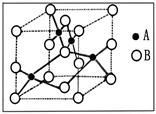
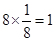 个镁原子;⑨是Ni,含有
个镁原子;⑨是Ni,含有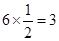 个Ni原子,所以化学式是MgCNi3或CMgNi3。
个Ni原子,所以化学式是MgCNi3或CMgNi3。

科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X元素形成的一种同素异形体是天然晶体中硬度最大的单质 |
| Y | 常温常压下,Y单质是淡黄色固体,用于制造黑火药 |
| Z | Z的基态原子核外有3个能级上有电子,且有3个单电子 |
| W | W元素形成的双原子分子,常温下为黄绿色气体,一种常见工业原料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )。
)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |

查看答案和解析>>
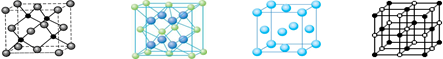
科目:高中化学 来源:不详 题型:填空题
| | A | B | C | D | E | F |
| 主要化合价 | -1 | -3 +5 | -2 +6 | -1 +7 | +2 | +1 +2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H4在氧气中充分燃烧生成的CO2与H2O的物质的量之比 |
| B.K2S溶液中c(K+)与c(S2-)之比 |
| C.Na2O2晶体中阳离子与阴离子的物质的量之比 |
| D.16O原子的中子数和质量数之比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com