
| A. | 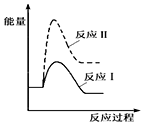 | B. | 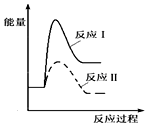 | ||
| C. | 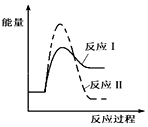 | D. | 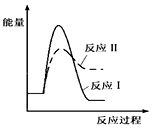 |
科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含有Cl- | |
| B. | 某溶液中先滴加稀硝酸酸化,再滴加几滴Ba(NO3)2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜和稀盐酸 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清的石灰水和稀硝酸反应 | D. | 醋酸和氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、氧气、碘酒 | B. | 小苏打、石灰水、二氧化硫 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) | |
| B. | 达到化学平衡时,4υ正(O2)=5υ逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水、氢氧化钾溶液、稀盐酸 | B. | 水、氢氧化钠溶液、稀盐酸? | ||
| C. | 水、硝酸银溶液、稀硝酸 | D. | 水、氢氧化钾溶液、稀硝酸? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
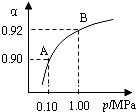 工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则
工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com