
已知0.1mol·L-1的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)
的值增大,可以采取的措施是 ( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.②④ D.③④
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
从原料和环境方面的要求看,绿色化学对生产中的化学反应提出一个提高原子利用率
的要求,即尽可能不采用那些对产品的化学组成来说没有必要的原料。现有下列3种
合成苯酚的反应路线:

其中符合原子节约要求的生产过程是( )
A.③ B.② C.① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.放热反应都是自发的,吸热反应都非自发
B.熵增大反应不一定自发,但自发反应熵一定增大
C.判断反应进行的方向,应综合考虑体系的焓变和熵变
D.自发反应是不可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
①福岛核电站泄漏的放射性物质含的 和
和 是互为同位素,化学性质几乎相同
是互为同位素,化学性质几乎相同
②大量燃烧化石燃料排放的废气中含大量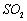 ,造成大气污染,从而使雨水的
,造成大气污染,从而使雨水的 ,形成酸雨
,形成酸雨
③大量排放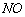 和
和 等氮氧化物是形成光化学烟雾和酸雨的一个重要原因
等氮氧化物是形成光化学烟雾和酸雨的一个重要原因
④高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
⑤在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
⑥石灰抹墙的硬化原理水泥砌墙的硬化原理相同
⑦SO2有漂白性,所以SO2可使溴水褪色
A.④⑤ B.①⑥⑦ C.①②③ D.②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
把铁与铜的混合物放入稀硝酸中,充分反应后固体有剩余,然后过滤,把滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的金属盐是( )
A.Cu(NO3)2 B.Fe(NO3)3 C.Fe(NO3)2 D.Fe(NO3)2和Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
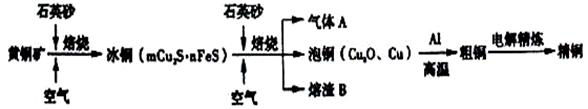
(1)气体A中的大气污染物可选用下列试剂中的 吸收。
A.浓H2SO4 B. 氨水 C.NaOH溶液 D.稀HNO3
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,检验溶液中还存
在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,
下列说法正确的是 。
a.粗铜接电源正极,发生氧化反应 b.溶液中Cu2+向阳极移动
c.利用阳极泥可回收Ag、Pt、Au等金属 d.电能全部转化为化学能
(5)利用反应2Cu+H2O2+H2SO4==CuSO4+2H2O可制得CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种溶液中,能大量共存的无色透明的离子组( )
A.PH=0的溶液: Fe2+ 、NO3-、SO42-、I-
B.C(H+)=10-14mol· L-1的溶液中:Na+ 、[Al(OH)4]-、S2-、SO32-
C.酸性环境下: Na+、 Cu2+、 NO3-、 SO42-、
D.使紫色石蕊试液变红的溶液中:K+ 、Na+ 、Ca2+ 、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)研究硫及其化合物性质有重要意义。
 硫酸工业生产中涉及如下反应:
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g) 2SO3(g)。向2L的容器中充入
2SO3(g)。向2L的容器中充入
2molSO2、1molO2,SO2的平衡转化率与温度的关系
如右图所示。
T1温度时反应进行到状态D时,v(正) v(逆)
(填“>”、“<”或“=”)。
温度为T1时,反应的平衡常数K= 。(单位必须写)
若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍 b. Q2一定等于Q1
c. 新平衡时SO2的转化率一定大于80% d. T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a. KNO3溶液 b. AlCl3溶液 c. Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+ 浓度之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com