
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)IO3-离子的立体构型的名称为____,中心原子的杂化方式为____。
(2)HIO4的酸性强于HIO3,其原因为____。
(3)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为____nm,与K紧邻的O的个数为____。
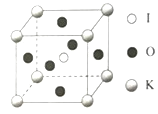
【答案】三角锥形 sp3杂化 HIO4中的非羟基氧原子数目更多,使得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强 ![]() ×0.446nm或0.386nm 12
×0.446nm或0.386nm 12
【解析】
(1)I3+的中心碘原子的价层电子对数为![]() ,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形,中心原子采用sp3杂化,故答案为:三角锥形;sp3杂化;
,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形,中心原子采用sp3杂化,故答案为:三角锥形;sp3杂化;
(2)HIO4中I的正电性更高,导致I—O—H中0的电子向I偏移,更容易电离出H+,酸性更强,所以HIO4的酸性强于HIO3,故答案为:HIO4中的非羟基氧原子数目更多,使得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强;
(5)由晶胞图可知,K原子处于顶角,I原子处于体心,两者的最近距离为立方体体对角线的一半,即![]() ×0.446nm或0.386nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子,故答案为:
×0.446nm或0.386nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子,故答案为:![]() ×0.446nm或0.386nm;12。
×0.446nm或0.386nm;12。


科目:高中化学 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A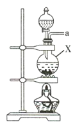 B
B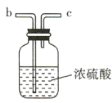
C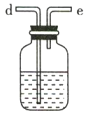 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
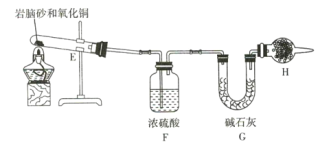
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的反应为SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
A.1B.3C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2),非平面结构,常温下是一种黄红色液体,有刺激性恶臭,熔点80℃,沸点135.6℃,对干二氯化二硫叙述正确的是
A.二氯化二硫的电子式为![]()
B.分子中既有极性键又有非极性键
C.二氯化二硫属于非极性分子
D.分子中S-Cl键能小于S-S键的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载“火法”冶炼锌: “炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是
A. 倭铅是指金属锌和铅的混合物
B. 煤炭中起作用的主要成分是C
C. 冶炼Zn的反应方程式为:ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D. 该冶炼锌的方法属于热还原法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△//=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△=2×(-57.3)kJ/mol
B.需要加热才能发生的反应一定是吸热反应
C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mo1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合液25mL,向其中逐渐加入铁粉,产生气体的物质的量随铁粉质量增加的变化如图所示(硝酸的还原产物为NO,忽略反应中的溶液体积变化)。下列有关说法错误的是( )

A.OA段产生的气体是NO,AB段发生的反应为Fe+2Fe3+=3Fe2+,BC段产生的气体是H2
B.由此推断该条件下,氧化性:NO3-强于Fe3+
C.OA段与BC段产生的气体的体积比为1:1
D.C点溶质的物质的量浓度为10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
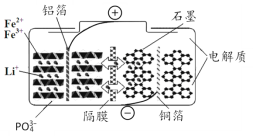
A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com