
草酸晶体(H2C2O4•2H2O)100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( )
A. 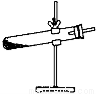 B.
B. 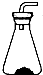 C.
C. 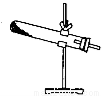 D.
D. 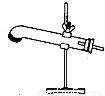
科目:高中化学 来源: 题型:选择题
| A. | 将废水加入紫色石蕊试剂中检验酸碱性 | |
| B. | 用玻璃棒蘸取废水样品,蘸在润湿的pH试纸上测定其pH | |
| C. | 测得该废水样品的pH=10,则废水样品中c(OH-)=10-10 mol/L | |
| D. | 该工业废水中c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
某离子反应中涉及 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 的物质的量随时间变化的曲线如图所示。下列判断中正确的是( )
的物质的量随时间变化的曲线如图所示。下列判断中正确的是( )

A.该反应的还原剂是
B.消耗 还原剂,转移
还原剂,转移 电子
电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是
① 将10.6 g Na2CO3 溶于100mL水中
② 将28.6g Na2CO3·10H2O溶于少量水中,再用水稀释至100 mL
③ 将20 ml 5.0 mol/L Na2CO3溶液用水稀释至100 mL
A.①② B.②③ C.只有② D.只有③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
已知mg气体A和ng气体B所含分子数相等,下列说法不正确的是
A.标准状况时,相同体积的气体A和气体B的质量之比为m:n
B.25℃时,相同质量的气体A和气体B的分子数之比为n:m
C.同温同压下,气体A和气体B的密度之比为n:m
D.通常状况下,相同质量的气体A和气体B的体积之比为n:m
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:推断题
有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子。同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种正盐中还含有下列离子中的一种,该离子是(填字母)_____________
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A___________B____________C__________
(3)不需要加入任何试剂就能将上述三种正盐溶液区分开来,鉴别出来的先后顺序为 (填字母)_______。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
Fe3+、SO42-、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是( )
A.Na+ B.OH- C.CO32- D.Cl-
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:计算题
碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。
其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为____________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;
③ 。
(3) 若pH过高,则对产品的影响是 。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
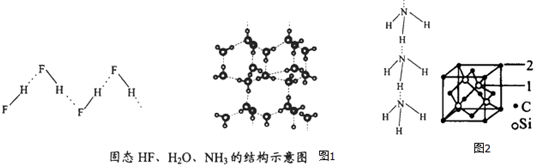
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com