
【题目】下列有关乙烯的叙述不正确的是( )
A. 乙烯分子中6个原子处于同一平面
B. 乙烯易溶于水,也易溶于有机溶剂
C. 乙烯分子中所含共价键的类型不止一种
D. 乙烯的产量是衡量一个国家石油化工发展水平的标志
科目:高中化学 来源: 题型:
【题目】Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24gNaOH配成的250mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
(1)NaOH溶液的物质的量浓度_____mol·L-1;
(2)某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-) =_____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574.0kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2 (g)+2H2O(g) △H=-1160.0 kJ/mol
③H2O(g)=H2O(1) △H=-44.0 kJ/mol
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(的热化学方程式是__________________。
(2)已知2NO(g)+O2(g)![]() 2 NO2(g)的反应历程分两步:
2 NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g)![]() 2 NO2(g) (慢) v2正=k2正·c (N2O2)·c(O2), v2逆=k2逆·c 2(NO2)
2 NO2(g) (慢) v2正=k2正·c (N2O2)·c(O2), v2逆=k2逆·c 2(NO2)
一定温度下,反应2NO(g)+O2(g)![]() 2 NO2(g)达到平衡状态,该反应的平衡常数的表达式K=______________________(用k1正、k1正、k2逆、k2逆表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)
2 NO2(g)达到平衡状态,该反应的平衡常数的表达式K=______________________(用k1正、k1正、k2逆、k2逆表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:

①T℃时,该反应的平衡常数为___________(保留两位有效数字)
②在31min时,若只改变某一条件使平衡发生移动,40min、50min时各物质的浓度如上表所示,则改变的条件是______________________。
③在51min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡___________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应N2O4(g)![]() 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(N2O2)=k1·p(N2O4),v(NO2)=k2·p2(NO2)其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(N2O2)=k1·p(N2O4),v(NO2)=k2·p2(NO2)其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。

在T℃时,图中M、N点能表示该反应达到平衡状态,理由是______________________。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁在空气中易被氧化,与硫酸铵反应生成硫酸亚铁铵[化学式为FeSO4·(NH4)2SO4·6H2O]后就不易被氧化。模拟工业制备硫酸亚铁铵晶体的实验装置如下图所示。请回答下列问题:
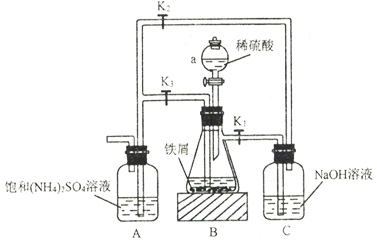
(1)仪器a的名称是______________________。
(2)铁屑中常含有Fe2O3、FeS等杂质,则装置C的作用是___________,装置B中发生反应的离子方程式可能是___________(填序号)。
A .Fe+2H+=Fe2++H2↑
B. Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++S2-=2Fe2++S↓
D.2Fe3++Fe=2Fe2+
(3)按上图连接好装置,经检验气密性良好后加入相应的药品,打开K1、K2,关闭K3,装置B中有气体产生,该气体的作用是___________。反应一段时间后,打开K3,关闭K1和K2。装置B中的溶液会流入装置A,其原因是______________________。
(4)按上图所示装置制备硫酸亚铁铵晶体的安全隐患是______________________。
(5)根据相关物质的溶解度判断,从装置A中分离出硫酸亚铁铵晶体,需采用的操作有___________、___________、洗涤、干燥。
三种盐的溶解度(单位为g/100gH2O)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙红色的![]() 与黄色的
与黄色的![]() 有下列平衡关系:
有下列平衡关系:![]() +H2O
+H2O![]()
![]() +2H+,把重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙色的。
+2H+,把重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________色,因为______________________________。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈________色,因为_________________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡________(填“向左移动”或“向右移动”),溶液颜色将______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
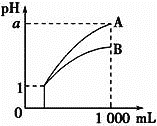
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙苯制备苯乙烯的反应为:![]()
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/KJ/mol | 412 | 348 | 612 | 436 |
下列说法错误的是
A. 上述反应的△H=+124kJmol﹣1 B. 乙苯比苯乙烯稳定
C. 乙苯中不存在碳碳双键 D. 1mol乙苯的能量与1mol苯乙烯能量相差264kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在恒容密闭容器中,反应2NO2 (g) ![]() N2O4(g) (正反应为放热反应)在一定条件下达到平衡,升高温度容器中气体颜色_____,向容器通人一定量的氦气容器中气体颜色_____。
N2O4(g) (正反应为放热反应)在一定条件下达到平衡,升高温度容器中气体颜色_____,向容器通人一定量的氦气容器中气体颜色_____。
(2)在一定条件下,可逆反应:mA+nB![]() 1/2pC达到平衡,若:
1/2pC达到平衡,若:
①A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是_____。
②A、C是气体,增加B的量,平衡不移动,则B为______________。
③A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是__________。(正向或逆向)
④加热后,可使C的质量增加,则正反应是____________反应(放热或吸热)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com