
(12��)��֪��
��XΪ±ԭ�ӣ�MΪ������������ȡ������)
���л���A�ϳ�G���㶹�أ��IJ������£�
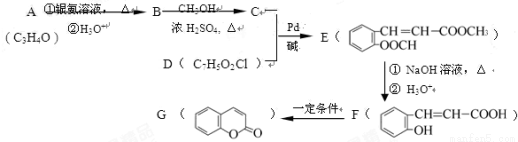
�ش��������⣺
��1��д��A����������������: ��F��G �ķ�Ӧ������ ��
��2��д��B��C�Ļ�ѧ����ʽ �� ��3��D�Ľṹ��ʽΪ ��
��4��F�ж���ͬ���칹�壬д��ͬʱ��������������һ��ͬ���칹��Ľṹ��ʽ�� ��
�����г������⣬��������״�ṹ��
���������������ڶ�λ��ȡ������
���ܷ���ˮ�ⷴӦ��������Na��Ӧ��
������������Cu(OH)2�����ʵ�����1:2��Ӧ
��5�������㶹�أ� ���������㶹�ص����Ʒ����������㶹�غ�����һ��ͬ���칹�壨
���������㶹�ص����Ʒ����������㶹�غ�����һ��ͬ���칹�壨 ����Ҫ�õ����Լ��У�NaOH��Һ�� ��
����Ҫ�õ����Լ��У�NaOH��Һ�� ��
��6����֪��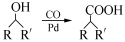 (R��R��Ϊ����)����д���Ա��ͱ�ϩ��
(R��R��Ϊ����)����д���Ա��ͱ�ϩ�� =CH��CH3��Ϊԭ�ϣ��ϳ�
=CH��CH3��Ϊԭ�ϣ��ϳ� ��·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
��·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�

��1��̼̼˫�� ȩ����1�֣���������Ӧ��ȡ����Ӧ�� ��1�֣�
��2��CH2=CHCOOH+CH3OH 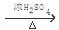 CH2=CHCOOCH3 +H2O ��2�֣�
CH2=CHCOOCH3 +H2O ��2�֣�
��3��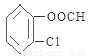 ��2�֣�
��2�֣�
��4��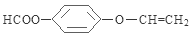 ��
��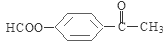 ��
��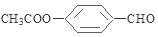 ��2�֣�
��2�֣�
��5��ϡ����ȡ�FeCl3��Һ������ˮ�ȣ���2�֣�
��6����2�֣�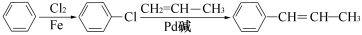
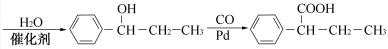
��������
�����������1��A����ʽ��C3H4O��A�����ܹ�����������Ӧ��˵������ȩ��������ݷ���ʽ��֪A��CH2=CH-CHO��A����̼̼˫�� ȩ����CH2=CH-CHO��������Һ����������Ӧ��Ȼ���ữ����B��CH2=CH-COOH;B��CH3OH�������������¼��ȷ���������Ӧ����C��CH2=CH-COOCH3������E�Ľṹ��֪��D�� ,C��D����ȡ����Ӧ����E��
,C��D����ȡ����Ӧ����E��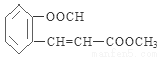 ;E��NaOH��ˮ��Һ�ڼ���ʱ����ˮ�ⷴӦ��Ȼ���ữ�õ�F��
;E��NaOH��ˮ��Һ�ڼ���ʱ����ˮ�ⷴӦ��Ȼ���ữ�õ�F��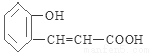 ;F��Ũ���������·��������ڵ�������Ӧ��ȡ����Ӧ�����õ�G��
;F��Ũ���������·��������ڵ�������Ӧ��ȡ����Ӧ�����õ�G��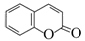 ����2��B��C�Ļ�ѧ����ʽ��CH2=CHCOOH+CH3OH
����2��B��C�Ļ�ѧ����ʽ��CH2=CHCOOH+CH3OH 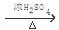 CH2=CHCOOCH3 +H2O����3��D�Ľṹ��ʽΪ
CH2=CHCOOCH3 +H2O����3��D�Ľṹ��ʽΪ ����4��F�ж���ͬ���칹�壬��ͬʱ���������Ģ� �����г������⣬��������״�ṹ�� ���������������ڶ�λ��ȡ�������� �ܷ���ˮ�ⷴӦ��������Na��Ӧ�� ������������Cu(OH)2�����ʵ�����1:2��Ӧ��һ��ͬ���칹��Ľṹ��ʽ��
����4��F�ж���ͬ���칹�壬��ͬʱ���������Ģ� �����г������⣬��������״�ṹ�� ���������������ڶ�λ��ȡ�������� �ܷ���ˮ�ⷴӦ��������Na��Ӧ�� ������������Cu(OH)2�����ʵ�����1:2��Ӧ��һ��ͬ���칹��Ľṹ��ʽ�� ��
�� ��
�� ����5����������㶹��
����5����������㶹��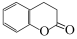 ������һ��ͬ���칹�壨
������һ��ͬ���칹�壨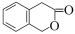 ���ķ����ǽ���Ҫ�õ���������NaOH��Һ��ϼ��ȣ�����ˮ�ⷴӦ��ǰ�߲��������ʺ��з��ǻ������ߺ��д��ǻ���Ȼ������Һ�м��������ữ���ټ���FeCl3��Һ������Һ��Ϊ��ɫ����֤��ԭ������
���ķ����ǽ���Ҫ�õ���������NaOH��Һ��ϼ��ȣ�����ˮ�ⷴӦ��ǰ�߲��������ʺ��з��ǻ������ߺ��д��ǻ���Ȼ������Һ�м��������ữ���ټ���FeCl3��Һ������Һ��Ϊ��ɫ����֤��ԭ������ ����������ɫ����ԭ����������һ��ͬ���칹�壨
����������ɫ����ԭ����������һ��ͬ���칹�壨 ��������Ҫ�õ���������NaOH��Һ��ϼ��ȣ�����ˮ�ⷴӦ��ǰ�߲��������ʺ��з��ǻ������ߺ��д��ǻ���Ȼ������Һ�м��������ữ���ټ�����ˮ����������ɫ��������֤��ԭ������
��������Ҫ�õ���������NaOH��Һ��ϼ��ȣ�����ˮ�ⷴӦ��ǰ�߲��������ʺ��з��ǻ������ߺ��д��ǻ���Ȼ������Һ�м��������ữ���ټ�����ˮ����������ɫ��������֤��ԭ������ ����������������ԭ����������һ��ͬ���칹�壨
����������������ԭ����������һ��ͬ���칹�壨 ������6���Ա��ͱ�ϩ��
������6���Ա��ͱ�ϩ��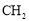 =CH��CH3��Ϊԭ�ϣ��ϳ�
=CH��CH3��Ϊԭ�ϣ��ϳ�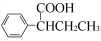 ��·���ǣ�
��·���ǣ�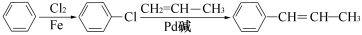
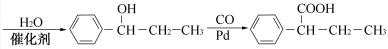 ��
��
���㣺�������ʵĽṹ�����ʡ����顢��Ӧ���͡���ѧ����ʽ��ͬ���칹�����д�����ʵ�ת������ȡ��֪ʶ��


 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
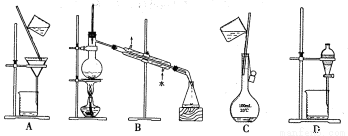
����ʵ������У����ڷ���ʳ���ͺ��Ȼ�����Һ����ѷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ǧ��о����Ҫ�ɷ���ʯī���������Щ���ʰ��ղ�ͬ�ı������Ի�͡�ѹ�ƣ��Ϳ����Ƴ�Ǧ��о�����Ǧ��о������һ��ɷ���ʯī������Ǧ��дһ�������ĵ�����ԼΪ1mg����ôһ��Ǧ���ֺ��е�̼ԭ����ԼΪ
A��2��5��1022�� B��2��5��1019��
C��5��1022�� D��5��1019��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ��������У�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾΪ800 �� ʱA��B��C�����������ܱ������з�ӦʱŨ�ȵı仯��ֻ����ͼ�β��ܵó��Ľ�����

A��A�Ƿ�Ӧ��
B��ǰ2 min A�ķֽ�����Ϊ0.1 mol��L��1��min��1
C����ƽ����������¶ȣ�ƽ��������Ӧ�����ƶ�
D����Ӧ�ķ���ʽΪ��2A(g)  2B(g) ��C(g)
2B(g) ��C(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ��������У�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��H2(g)��F2(g)===2HF(g) �������仯��ͼ��ʾ�������й���������ȷ����
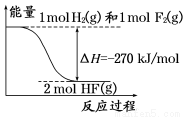
A������������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ
B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ
C������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
D������1 mol H��H����1 mol F��F ���ų������������γ�2 mol H��F���ų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ơ��������W1gͶ��һ����ˮ�г�ַ�Ӧ������û��ʣ�࣬���ռ�����״���µ�����V1L����Ӧ�����Һ����μ���Ũ��Ϊa mol��L��1�����ᣬ�ڴ˹������а�ɫ�������ɺ������ܽ⣬������ǡ����ʧʱ�����������ΪV2L,����Һ���ɡ����յù���W2g�����й�ϵʽ�������
A��35��5aV2=W2-W1 B��23n(Na)+27n(Al)=W1
C��n(Na)+3n(Al)=2V1/22��4 D��aV2=V1/11��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ײʱ����ȫ�����з�����Ӧ10NaN3+2KNO3 = K2O+5Na2O+16N2��������������Ȼ�ԭ�����1.75 mol���������жϴ������
A����0��250 mol KNO3������
B������44.8 L N2����״����
C��ת�Ƶ��ӵ����ʵ���Ϊ1.25 mol
D����������Nԭ�ӵ����ʵ���Ϊ3.75 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��10�֣� CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ���������ֵ�Ļ�ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��1��250 ��ʱ�������Ͻ�Ϊ�����������Ϊ4 L���ܱ�������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2(g)��CH4(g) 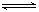 ?2CO(g)��2H2(g)��
?2CO(g)��2H2(g)��
ƽ����ϵ�и�����������(ijһ�ɷ����ʵ���ռ���������ʵ����İٷ���)���±���
���� | CH4 | CO2 | CO | H2 |
������� | 0.1 | 0.1 | 0.4 | 0.4 |
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K��________��
����֪��CH4(g)��2O2(g)===CO2(g)��2H2O(g) ��H����890.3 kJ��mol��1
CO(g)��H2O(g)===CO2(g)��H2(g) ��H����2.8 kJ��mol��1
2CO(g)��O2(g)===2CO2(g) ��H����566.0 kJ��mol��1
��ӦCO2(g)��CH4(g) ===?2CO(g)��2H2(g) ��H��________��
��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч���������������������ͼ��ʾ��250��300 ��ʱ��������������ʼ�С��ԭ����__________________________________________________��

�ڽ�Cu2Al2O4�ܽ���ϡ�����е����ӷ���ʽΪ_______________________________��
��3����CO2Ϊԭ�Ͽ��Ժϳɶ������ʡ�
��ϳɾ�̼��������֪CO2�ķ��ӽṹΪO===C===O�����ġ�C===O��˫������ϩ�ġ�C===C��˫��һ������һ�������¿ɷ����Ӿ۷�Ӧ����̼������һ����������ͺϳɲ��ϣ�������CO2�Ӿ۶��ɡ�д����̼�����Ľṹ��ʽ��______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ����У������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ײʱ����ȫ�����з�����Ӧ�� ���������жϴ������
���������жϴ������
A���÷�Ӧ����˲����ɣ���������������
B�����ɱ�״����2.24L���壬�÷�Ӧת�Ƶ��ӵ����ʵ���Ϊ0.5mol
C���÷�Ӧ�е�������ΪKNO3
D���������ͱ���ԭ��Nԭ�ӵ����ʵ���֮��Ϊ15��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com