
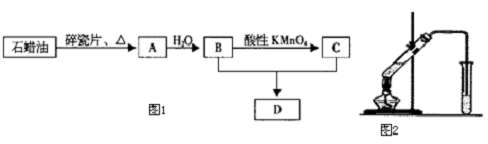
分析 A产量可以衡量一个国家石油化工水平的高低,则A应为CH2=CH2,石蜡油发生裂解得到乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成C为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成D为CH3COOCH2CH3,据此解答.
解答 解:A产量可以衡量一个国家石油化工水平的高低,则A应为CH2=CH2,石蜡油发生裂解得到乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成C为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成D为CH3COOCH2CH3.
(1)工业上,利用沸点不同,由石油分馏获得石蜡油,由石蜡油获得乙烯属于裂解,是化学变化,故答案为:分馏;化学;
(2)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,加成反应;
(3)反应B+C→D是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式是:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,属于取代反应,
故答案为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,取代反应;
(4)A为CH2=CH2,与CH3CH=CH2(丙烯)互为同系物,
故答案为:D;
(5)实验室制备乙酸乙酯,收集产物的试管中盛放的液体为:饱和碳酸钠溶液,该溶液可以除去产物中的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于溶液分层,
故答案为:饱和碳酸钠溶液;①乙酸和乙醇;②降低乙酸乙酯在水中的溶解度,便于溶液分层.
点评 本题考查有机物推断、乙酸乙酯的制备等,涉及烯烃、醇、羧酸、酯的性质与转化,侧重对基础知识的巩固.


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始各物质的物质的量(mol) | 达到平衡时能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出23.15kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出QkJ能量 |
| A. | 容器①、②中反应的化学平衡常数相等 | |
| B. | 平衡时,两容器中氨的体积分数均约为14.3% | |
| C. | 反应②达到平衡时,放出的热量Q=23.15 kJ | |
| D. | 若①的体积为5.0 L,则达到平衡时放出的热量小于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
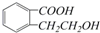 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.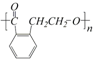 E.
E.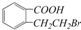
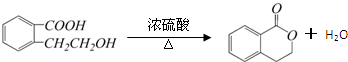 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
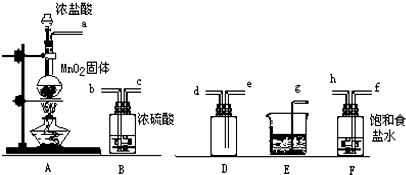
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (提示:环丁烷
(提示:环丁烷  可简写成
可简写成  )
)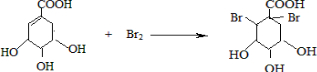
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
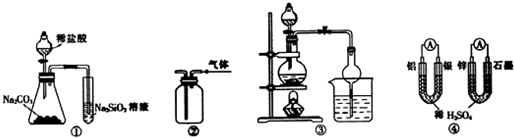
| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置通过排空气法收集C2H4气体 | |
| C. | 图③所示装置可用于制取乙酸乙酯,分液漏斗中装的是乙醇 | |
| D. | 图④两个装置红中能够通过导线的电子数相同时,生成的H2的物质的量也相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com