
常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )
A.加入金属镁产生H2的溶液中:NH 、Na+、SO
、Na+、SO 、CH3COO-
、CH3COO-
B.含有大量ClO-的溶液中:K+、Na+、NO 、SO
、SO
C.c(Cu2+)=0.1 mol·L-1的溶液中:H+、NH 、Br-、CO
、Br-、CO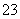
D.含有大量MnO 的溶液中:H+、SO
的溶液中:H+、SO 、Cl-、CH3CH2OH
、Cl-、CH3CH2OH
科目:高中化学 来源: 题型:
一定条件下反应2AB(g) 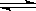 A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成n molA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率 D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5 mol/L,Mg2+为0.5 mol/L,则SO42-的物质的量浓度为 ( )
A.0.1 mol/L B.0.5 mol/L C.0.15 mol/L D.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:


③若转移10 mol e-,则反应后生成I2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-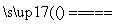 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO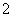 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO
D.用食醋除去水瓶中的水垢:CO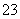 +2CH3COOH===2CH3COO-+CO2↑+H2O
+2CH3COOH===2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+5/2O2(g)―→2CO2(g)+H2O(l)
ΔH=-1 300 kJ/mol
②C6H6(g)+15/2O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ/mol
下列说法正确的是( )
A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C.相同条件下,等质量的C2H2(g)与C 6H6(g)完全燃烧,C6H6(g)放热更多
6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是高耗能产业,一种将电解池与燃料电池相结合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中甲、乙、丙、丁均为石墨电极。
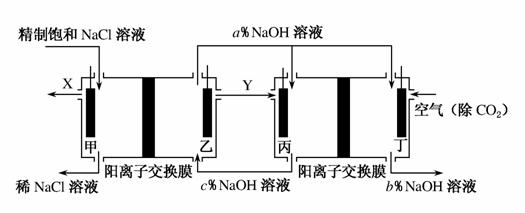
(1)为了有效除去粗盐中混有的Ca2+、Mg2+、SO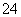 ,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
A.先加足量Ba(OH)2,再加足量Na2CO3,最后加入适量稀盐酸
B.先加足量NaOH,再加足量Na2CO3,然后加足量BaCl2,最后加入适量稀盐酸
C.先加足量Na2CO3,再加足量BaCl2,然后加足量NaOH,最后加入适量稀盐酸
D.先加足量Ba(NO3)2,再加足量NaOH,然后加足量Na2CO3,最后加入适量稀盐酸
(2)丙电极为________极,该电极的电极反应式为____________________________________。
(3)乙电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(4)若装置中通过0.5 mol e-,则理论上生成标准状况下X的体积为________。
(5)图中NaOH溶液的质量分数a%、b%、c%由大到小的顺序为________。
(6)这样设计的主要节能之处在于(任写1条)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物12 g完全燃烧,生成7.2 g H2O和8.96 L CO2(标准状况下),0.5 mol此有机物的质量为30 g。
(1)求分子式。
(2)又知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,试写出它可能的结构简式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com