
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
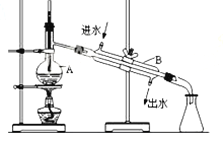
(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
科目:高中化学 来源: 题型:
【题目】(1)0.5mol某固体A的质量是30g,A的摩尔质量为_________。
(2)在同温同压同体积的条件下,H2与气体B的密度之比是1∶8,则B的相对分子质量为_____。
(3)在25℃ 101kPa的条件下,同质量的CH4和C气体的体积之比是15∶8,则1摩尔C的质量为______。
(4).质量之比为8∶7∶6的三种气体SO2、CO、NO,其分子数之比为_____;氧原子数之比为______;相同条件下的体积之比为_____。
(5)4.8g碳在一定量的氧气中燃烧,反应后生成的气体质量为12.8g。则在标准状况下,生成物CO和CO2的体积比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线如图所示:

(1)用系统命名法命名A的名称是__________,E中含氧官能团的名称是____________。
(2)反应② 的条件是_______________________,反应⑦中所属反应类型是___________。
(3)写出下列反应的化学方程式:反应①________________;反应⑦_________________。
(4)芳香族化合物M是H的同分异构体,1 mol M与足量碳酸氢钠溶液反应生成2 molCO2 ,M的同分异构体有_____种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为_____________(任写一种)。
(5)写出以甲醇和丙二酸为原料,合成丙烯酸(CH2=CH—COOH)的合成路线(其它试剂任选)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下表25℃时某些弱酸的电离平衡常数,判断下列说法正确的是
CH3COOH | HC1O | H2CO3 |
Ka=1.8×l0-5 | Ka=3.0×l0-8 | Ka1=4.4×l0-7 Ka2=4.7×l0-11 |
A. 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O==2HC1O+CO32-
B. 相同浓度的CH3COOH和NaClO的溶液中,水的电离程度前者大
C. 向0. lmol L-l的CH3COOH溶液中滴加NaOH溶液至pH = 5,此时溶液的 c(CH3COOH):c(CH3COO-) =5∶9
D. 常温下,0 lmol L-1 的 NaHC2O4 溶液 pH =4: c(HC2O4-) >c(H+)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条直接投入到盛有盐酸的敞口容器中,产生H2的速率如图所示,
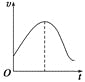
在下列因素中,影响反应速率的因素是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④B. ③④C. ①②③D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在化学工业中有着重要的应用,回答下列问题:
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为______________________。
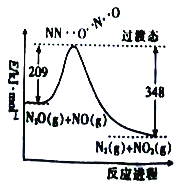
(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________;若有1mol硝酸铵完全分解,则转移电子的数目为___________(设NA为阿伏加德罗常数的值)。
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-![]() O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
①该反应在60~90s与90~120s内的平均反应速率分别约为___________,___________;比较两者大小可得出的结论是______________________。
②计算T℃时该反应的平衡常数为______________________。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)△H= - 92.4kJmol-1,在反应过程中,正反应速率的变化如图.下列说法不正确的是( )
2NH3(g)△H= - 92.4kJmol-1,在反应过程中,正反应速率的变化如图.下列说法不正确的是( )
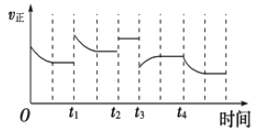
A. t1时增大了压强
B. t2时使用了催化剂
C. t3时降低了温度
D. t4时从体系中分离出部分氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关说法错误的是( )
A. 苯乙烯可发生加聚反应 B. 苯乙烯在一定条件下可与液溴发生取代反应
C. 苯乙烯分子中所有碳原子一定共平面 D. 苯乙烯的苯环上的一氯代物有3 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com