
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | 有单质参加或生成的反应不一定属于氧化还原反应 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
分析 A.二氧化碳为非电解质;
B.氧化铝为两性氧化物;
C.同素异形体之间的转化为非氧化还原反应;
D.根据微粒直径的大小将分散系分为溶液、浊液和胶体.
解答 解:A.二氧化碳为非电解质,故A错误;
B.氧化铝与酸、碱反应都生成盐和水,为两性氧化物,故B错误;
C.同素异形体之间的转化为非氧化还原反应,如氧气和臭氧,都有单质参加反应,但不是氧化还原反应,故C正确;
D.根据分散系分散质微粒直径将分散系分为溶液、胶体和浊液,故D错误.
故选C.
点评 本题考查较为综合,为高频考点,侧重于学生的分析能力的考查,注意把握物质的分类,题目难度不大,注意物质的分类的依据,不同的分类标准会得出不同的分类结果.


科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++SO32-+H2O | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题: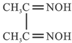 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
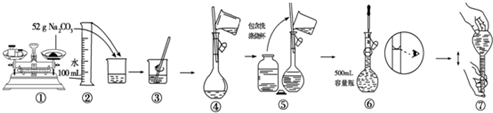
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,阴极的电极反应式为pb2++2e-═pb | |
| C. | 放电时,转移1mol电子时负极减少的质量为103.5g | |
| D. | 放电时,正极的电极反应式为PbO2+2e-+4H+═pb2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用480 mL 容量瓶 | |
| B. | 把烧碱固体放在纸上称量 | |
| C. | 把称好的固体放入容量瓶中稀释至刻度线 | |
| D. | 定容时俯视容量瓶的刻度线浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
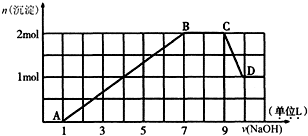
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com