
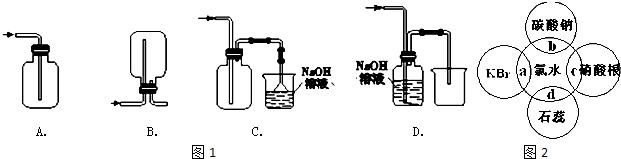
分析 (1)依据氯气密度大于空气密度,可溶于水的有毒气体的物理性质选择正确的收集方法;
(2)依据强酸制备弱酸规律,盐酸与次氯酸钙反应生成氯化钙和次氯酸;
漂白粉与浓盐酸发生氧化还原反应生成氯气、氯化钙和水;
(3)①依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
②分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)氯气与水反应生成盐酸和次氯酸,氯水中含有:H2O、HClO、Cl2、Cl-、ClO-,H+、OH-,依据各种离子的性质解答.
解答 解:(1)A.只有进气口,没有出气口,无法排出气体,故A错误;
B.此装置是用来收集比空气轻的气体,若收集氯气,应选择向上排空气法,需要短进长出,故B错误;
C.装置长进短出可以收集比空气重的气体氯气,剩余的氯气有毒需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,故C正确;
D.氯气通入NaOH溶液会发生反应.氯气被氢氧化钠吸收,不能收集到氯气,故D错误;
故选:C;
(2)盐酸与次氯酸钙反应生成氯化钙和次氯酸,反应的化学方程式:Ca(ClO)2+2HCl=CaCl2+2HClO;
漂白粉与浓盐酸发生氧化还原反应生成氯气、氯化钙和水,化学方程式:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
故答案为:Ca(ClO)2+2HCl=CaCl2+2HClO;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(3)①配制250.00mL 0.1000mol/L的KMnO4溶液的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、250mL容量瓶,所以还缺失的仪器:250mL的容量瓶;
②a.加水定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故不选;
b.容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
c.颠倒摇匀后发现凹液面低于刻度线又加水补上,导致溶液体积偏大,故选;
故答案为:①250mL的容量瓶; ②c;
(4)①氯水中含有氢离子,遇到石蕊显红色,又因为含有次氯酸,次氯酸具有漂白性,溶液最后褪色;
故答案为:d;
②氯水中含有氯离子,氯离子与银离子反应生成氯化银白色沉淀,
故答案为:有白色沉淀生成.
点评 本题为实验题,考查了氯气的制备、收集、性质,一定物质的量浓度溶液的配制,氯水的性质,题目难度不大,掌握基础是解题关键,题目难度不大.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H>0△S>0 | |
| B. | 铅蓄电池放电时的负极和充电时的正极均发生氧化反应 | |
| C. | 氯化镁溶液加热蒸干得不到纯净氯化镁固体 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂只有锂 | |
| B. | SOCl2中每个原子都达到8电子稳定结构 | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | 生成1.12 LSO2时,反应转移电子为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 | |
| B. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成可溶性的Ca(HCO3)2的缘故 | |
| C. | 硫酸、纯碱、小苏打和二氧化硫分别属于酸、碱、盐和酸性氧化物 | |
| D. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净化水 | B. | 用氢氧化铝治疗胃酸过多 | ||
| C. | 用铝制容器存放浓硫酸 | D. | 电解熔融氧化铝制单质铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液能用于腐蚀铜线路板 | B. | 用小苏打治疗胃酸过多 | ||
| C. | 过氧化钠作供氧剂 | D. | 用还原性铁粉作食品抗氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com