
| A. | C(s)+O2(g)═CO2(g);△H=+393.5kJ•mol-1 | |
| B. | 2SO2+O2═2SO3;△H=-196.6kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6KJ | |
| D. | H2(g)+1/2O2(g)═H2O(l);△H=-285.8kJ•mol-1 |
分析 A、碳的燃烧释放热量,焓变是负值;
B、热化学方程式要注明物质的聚集状态;
C、焓变的单位是kJ/mol;
D、根据热化学方程式的以及以及书写方法来回答.
解答 解:A、碳的燃烧释放热量,焓变是负值C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1,故A错误;
B、热化学方程式要注明物质的聚集状态,选项中没标,故B错误;
C、焓变的单位是kJ/mol,2H2(g)+O2(g)═2H2O(l);△H=-571.6KJ/mol,故C错误;
D、氢气燃烧生成水的反应释放热量,焓变为负值,符合热化学方程式的书写原则,故D正确.
故选D.
点评 本题考查了热化学方程式书写方法和正误判断,掌握基础是关键,题目较简单.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol•L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
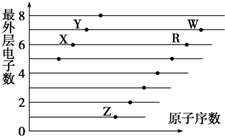
| A. | X和R在同一主族 | |
| B. | 含氧酸酸性:W>R | |
| C. | X与W可以形成酸性氧化物 | |
| D. | X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(4)(3)(2) | B. | (4)(1)(3)(2) | C. | (4)(2)(1)(3) | D. | (1)(3)(4)(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol•L-1•s-1 | B. | 0.015mol•L-1•s-1 | ||
| C. | 0.12mol•L-1•s-1 | D. | 0.06mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com