
| 选项 | 实验 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状 | 浓硫酸具有吸水性和强氧化性 |
| B | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,沉淀为BaSO3 |
| D | 常温下,将铁片浸入足量浓硫酸中 | 铁片上无明显现象 | 常温下,铁与浓硫酸没有发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓硫酸具有脱水性,可将有机物中的氢氧原子以2:1脱去,表现为强氧化性,在反应中S元素化合价降低,被还原生成二氧化硫;
B.实现了沉淀的转化,说明氢氧化铜更难溶,难溶物的溶度积越小越难溶;
C.二氧化硫被氧化成硫酸,生成的沉淀为硫酸钡;
D.常温下铁与浓硫酸发生了钝化现象,不是不反应.
解答 解:A.向蔗糖中加入浓硫酸,蔗糖变黑,说明蔗糖被碳化,膨胀并有刺激性气味的气体放出,说明发生氧化还原反应生成二氧化碳、二氧化硫,浓硫酸表现了脱水性和强氧化性,故A错误;
B.将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,说明NaOH完全反应,再滴加0.1mol•L-1CuSO4溶液,先有白色沉淀生成后变为浅蓝色沉淀,说明发生了沉淀的转化,溶度积大的物质向溶度积小的物质转化,所以Cu(OH)2的溶度积比Mg(OH)2的小,故B正确;
C.FeCl3和BaCl2混合溶液中通入足量SO2,铁离子与二氧化硫发生氧化还原反应,Fe3+被还原为Fe2+,同时生成BaSO4,故C错误;
D.常温下,将铁片浸入足量浓硫酸中,由于发生了钝化现象,阻止了反应的继续进行,并不是不反应,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及浓硫酸性质、难溶物溶解平衡及沉淀转化、氧化还原反应等知识,明确常见元素及其化合物性质即可解答,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
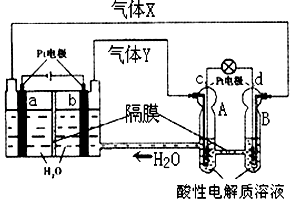 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | c极上进行还原反应,B中的H+可以通过隔膜进入A | |
| B. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| C. | 该装置开始工作后,右端装置能量变化为:电能→化学能 | |
| D. | 当有0.2mol电子转移时,a极产生1.12L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物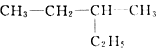 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| B. | 2-甲基丁烷和2,2-二甲基丙烷互为同系物 | |
| C. | 常温下,乙烯和苯都能被酸性KMnO4氧化,使KMnO4溶液褪色 | |
| D. | 等物质的量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | 仅①②③ | C. | 仅①③④ | D. | 仅②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
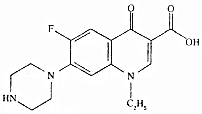
| A. | 该化合物属于苯的同系物 | |
| B. | 分子式为Cl6 H16FN3O3 | |
| C. | 1mol该化合物中含有6NA个双键 | |
| D. | 该化合物能与酸性高锰酸钾、溴水、碳酸氢钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为16的硫原子:${\;}_{32}^{48}$S | B. | Cl的结构示意图: | ||
| C. | 甲酸甲酯的结构简式:HCOOCH3 | D. | 氢氧化钠的电子式: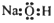 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3属于两性氧化物 | B. | 胆矾(CuSO4•5H2O)属于纯净物 | ||
| C. | NaHCO3属于强电解质 | D. | 纯碱属于碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com