
现有:①铁锅②鸡蛋③白酒④乙烯。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)。
(1)可以作为水果催熟剂的是 ;(2)含有乙醇的是 ;
(3)在潮湿的空气中会生锈的是 ;(4)富含蛋白质的是 。
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
用氢氧化钠固体配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
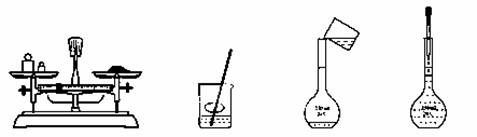
A.称量 B.溶解 C.转移 D.定容
查看答案和解析>>
科目:高中化学 来源: 题型:
联合国卫生组织将铁锅作为一种理想的炊具向世界推广,其主要原因是
A.吸热慢、散热也慢、宜于食物保温
B.烹饪出的食物中含有对人体有益的元素
C.生产过程简单、不易生锈、价格便宜
D.生铁中含有碳元素、能产生对人体有益的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.PM 2.5的产生与人类活动无关
B.硅晶体是现代光学及光纤制品的基本原料
C. 75%酒精可使蛋白质变性,故能用其消毒杀菌
D.塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的各组离子,通入过量SO2气体后仍能大量存在的是
A.Ba2+、Ca2+、Cl- B.OH-、CO32-、Na+
C.Ca2+、CO32-、Cl- D. H+、Fe3+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应6 NO2+8NH3  7N2+12 H2O可处理NO2,当转移1.2mol电子时,消耗的NO2在标况下是 L。
7N2+12 H2O可处理NO2,当转移1.2mol电子时,消耗的NO2在标况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= —196.6 kJ·mol-1
2SO3(g) ΔH= —196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= —113.0kJ·mol-1
2NO2(g) ΔH= —113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1∶2置于容积固定的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积之比为1∶6,则平衡常数K=
 (3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是
。
Ⅱ.镍及其化合物与生产、生活密切相关。
(4)镍与CO反应,生成的Ni(CO)4
受热易分解,化学反应方程式为
Ni(s)+4CO(g) 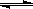 Ni(CO)4(g)。
Ni(CO)4(g)。
吸烟时,烟草燃烧生成的CO吸入人体后会与血红蛋白结合成稳定的物质,使血液的的携氧功能受到影响,同时烟草中少量Ni也与CO反应生成Ni(CO)4进入血液,并不断分解出Ni使人体重金属中毒。从化学平衡的角度分析,促使Ni(CO)4在血液中不断分解的原因是 。
(5)混合动力车通常使用碱性镍氢充放电池,其总反应为:
H2+2NiOOH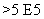 2Ni(OH)2,混合动力车在刹车或下坡时,电池处于充电状态,此时阳极的电极反应式为_ 。
2Ni(OH)2,混合动力车在刹车或下坡时,电池处于充电状态,此时阳极的电极反应式为_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和 。
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是 。
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。
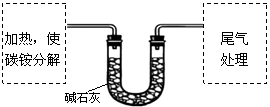 |
(1)碳铵固体应放在 中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(2)从安全的角度考虑,尾气处理的装置可以选用 。

A B C D
(3)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是 g。
(4)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理。 (填“合理”“不合理”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com