
| A. | 1mol氦气中含有2NA个氦原子 | |
| B. | 14g氮气中含有NA个氮原子(氮的相对原子质量为14) | |
| C. | 46g NO2中含有氧原子2NA | |
| D. | 18g水中所含有的电子数为8NA |
分析 A、氦气为单原子分子;
B、氮气由氮原子构成;
C、求出二氧化氮的物质的量,然后根据1mol二氧化氮中含2mol氧原子来分析;
D、求出水的物质的量,然后根据水为10电子微粒来分析.
解答 解:A、氦气为单原子分子,故1mol氦气中含NA个氦原子,故A错误;
B、氮气由氮原子构成,故14g氮气中含1mol氮原子即NA个,故B正确;
C、46g二氧化氮的物质的量为1mol,而1mol二氧化氮中含2mol氧原子,故含2NA个,故C正确;
D、18g水的物质的量为1mol,而水为10电子微粒,故1mol水中含10NA个电子,故D错误.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖银镜反应实验后的试管内壁附有银,可用氨水清洗 | |
| B. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| C. | 用标准酸溶液滴定未知碱溶液时,盛装待测溶液的锥形瓶不需要用待测溶液润洗 | |
| D. | 测定溶液pH的操作:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在试纸中部 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | R | Y | |
| Z | W |
| A. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| B. | W和R只能形成一种化合物WR3,且为酸性氧化物 | |
| C. | X的最高价含氧酸与它的简单气态氢化物发生氧化还原反应 | |
| D. | Z与R形成的化合物ZR2是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
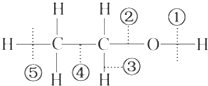
| A. | 和金属钠反应时键①断裂 | |
| B. | 在铜催化共热下与O2反应时断裂①和③ | |
| C. | 在浓H2SO4催化共热下与CH3COOH反应时断裂② | |
| D. | 在空气中完全燃烧时断裂①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com