
| A. | 少量金属钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 60 mL 1 mol/L纯碱溶液与20 mL 2 mol/L胆矾溶液混合(无气体放出):3CO32-+2Cu2++2H2O=2HCO3-+Cu2(OH)2CO3↓ | |
| C. | 向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑ | |
| D. | 向碳酸氢钙溶液中加入少量KOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
分析 A.电子不守恒;
B.反应生成碳酸氢钠、Cu2(OH)2CO3;
C.Na218O2为氧化剂和还原剂;
D.少量KOH,反应生成碳酸钙、碳酸氢钾、水.
解答 解:A.少量金属钠投入水中的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.60 mL 1 mol/L纯碱溶液与20 mL 2 mol/L胆矾溶液混合(无气体放出)的离子反应为3CO32-+2Cu2++2H2O=2HCO3-+Cu2(OH)2CO3↓,故B正确;
C.向H2O中投入少量Na218O2固体的离子反应为:2H2O+2Na218O2=4Na++2OH-+218OH-+18O2↑,故C错误;
D.向碳酸氢钙溶液中加入少量KOH溶液的离子反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断及离子反应中保留化学式的物质、电子和电荷守恒,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷 耐高温 | B. | 氧化锆陶瓷 韧性和耐磨性 | ||
| C. | 钛酸钡陶瓷 导电性 | D. | 氧化铝陶瓷 透光性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3互为同素异形体 | B. | 16O与18O核外电子排布不同 | ||
| C. | 麦芽糖与蔗糖互为同分异构体 | D. | CH3CH3与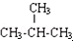 互为同系物 互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作、现象 | 结 论 | |
| A | 火柴梗上滴少量的浓硫酸;火柴梗变黑 | 浓硫酸具有强氧化性 |
| B | 含锈的铁浸泡在NH4Cl溶液中,铁锈逐渐溶解 | NH4Cl显酸性 |
| C | Ba(NO3)2溶液中通入SO2气体;产生白色沉淀 | BaSO3难溶 |
| D | 某无色溶液中通入过量的CO2气体,有白色沉淀 | 一定含有AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的水溶液中:K+、Ba2+、Cu2+、I- | |
| B. | 含有大量H+的水溶液中:NH4+、Fe2+、SO42-、MnO4- | |
| C. | c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br- | |
| D. | 强碱性溶液中:Cl-、SO32-、HSO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色酸性溶液中:Al3+、Cl-、Fe3+、SO42- | |
| B. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、NO3- | |
| C. | 0.1mol•L-1NaHCO3溶液中:K+、AlO2-、Cl-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe3+、Ca2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com