
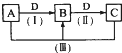
 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题. ,
, ;
;| 10-14 |
| 10-a |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
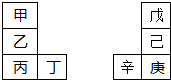
| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa(固体) |
| B、NH4Cl(固体) |
| C、CuSO4(溶液) |
| D、Ba(OH)2(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中,负极上发生的反应是氧化反应 |
| B、原电池中,电流从负极流向正极 |
| C、铜锌原电池中放电时,溶液中的阴离子向负极移动,阳离子向正极移动 |
| D、碱性锰锌电池是一次电池,铅蓄电池是二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
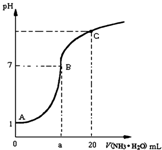 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com