
 、④HCHO等,其中碳原子不是采取sp2杂化的分子有②(填物质编号),HCHO分子的立体构型为平面三角形.
、④HCHO等,其中碳原子不是采取sp2杂化的分子有②(填物质编号),HCHO分子的立体构型为平面三角形. 分析 (1)HF分子之间形成氢键,水分子之间形成氢键,HF与水分子之间形成2种氢键;分子(CN)2中碳原子按sp杂化,碳碳之间是单键,碳氮之间是参键,碳氮参键中有两个π键,据此判断;
(2)因为Ni0的晶体结构类型与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6,根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据价层电子对互斥理论判断甲醛的空间构型.
解答 解:(1)HF分子之间形成氢键,水分子之间形成氢键,HF与水分子之间形成2种氢键(H-F…H-O、H-O…H-F),氟化氢水溶液中存在的氢键有4种氢键;
分子(CN)2中碳原子按sp杂化,碳碳之间是单键,碳氮之间是参键,其结构式为:N≡C-C≡N,碳氮参键中有两个π键,所以1个分子中含有4个π键,
故答案为:4;N≡C-C≡N;4;
(2)NiO的晶体结构类型与氯化钠相同,氯化钠中钠离子和氯离子配位数都是6,所以NiO中Ni和O的配位数都是6,
①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故①正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故②错误;
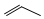
③ 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故③正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故③正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故④正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形,
故答案为:6;②;平面三角形.
点评 本题考查氢键、配位数、分子的立体构型等知识,侧重考查杂化轨道理论的灵活应用,难点是计算配位数,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水通入足量SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| B. | 将Ba(OH)2溶液滴入NaHSO4溶液中至SO42-恰好完全沉淀:Ba2++SO42-+2OH-+2H+═BaSO4↓+2H20 | |
| C. | 向醋酸溶液中滴加过量NaOH溶液:H++OH-═H2O | |
| D. | 向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{加热}{→}$ CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是直线型分子,推测CS2是直线型分子 | |
| B. | Cl?与Fe3+共存,推测I?与Fe3+共存 | |
| C. | H2SO4为强酸,推测HC1O为强酸 | |
| D. | 蒸干Al2(SO4)3溶液得到Al2(SO4)3固体,推测蒸干AlCl3溶液得到AlCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
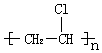 的单体是CH2=CHCl.
的单体是CH2=CHCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与Ba(OH)2溶液混合 | B. | 氢氧化镁溶于盐酸 | ||
| C. | 澄清石灰水与硝酸混合 | D. | 醋酸除去水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na→Na2O2 | B. | SiO2→H2SiO3 | C. | Fe(OH)2→Fe(OH)3 | D. | Cu→CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com