
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
|
| A. | Na2O2只作氧化剂 |
|
| B. | Na2FeO4既是氧化产物又是还原产物 |
|
| C. | O2是还原产物 |
|
| D. | 2mol FeSO4发生反应时,反应中共有8mol电子转移 |
考点:
氧化还原反应;氧化还原反应的电子转移数目计算.
专题:
氧化还原反应专题.
分析:
A、化合价降低元素所在的反应物是氧化剂;
B、还原剂被氧化得到氧化产物,氧化剂被还原得到还原产物;
C、氧化剂被还原得到还原产物;
D、反应中元素化合价升高的数目就是反应中转移电子的数目.
解答:
解:A、过氧化钠中氧元素的化合价有的升高到0价有的降低到﹣2价,所以Na2O2即是氧化剂,又是还原剂,故A错误;
B、反应中,Na2FeO4中的铁元素化合价为+6价,是从硫酸亚铁中+2价的铁元素升来的,所以硫酸亚铁是还原剂,被氧化得到氧化产物Na2FeO4,同时过氧化钠中的﹣1价的氧元素化合价降低,Na2FeO4中的﹣2价氧元素就来自过氧化钠,所以Na2FeO4又是还原产物,故B正确;
C、氧气中0价的氧元素是过氧化钠中﹣1价的氧元素升高来的,所以氧气是氧化产物,故C错误;
D、反应中元素化合价升高的数目为:2×(6﹣2)+2×(1﹣0)=10,所以2molFeSO4发生反应时,反应中转移电子的数目为10mol,故D错误.
故选B.
点评:
本题目考查学生氧化还原反应中的有关概念以及电子守恒定律,可以根据所学知识来灵活运用,难度不大.


科目:高中化学 来源: 题型:
在一定条件下,在2X(g)+Y(g)2Z(g)的平衡体系中,X、Y、Z的浓度分别是2 mol·L-1,0.8 mol·L-1,2.4 mol·L-1,则Y在起始时的浓度可能是( )
A.0.8~2 mol·L-1 B.0~2 mol·L-1
C.0~0.8 mol·L-1 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
现有①BaCl2 ②金刚石 ③KOH ④H2SO4 ⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 ,熔点最高的是 ,熔点最低的是 .
(2)属于离子化合物的是 ,只有离子键的物质是 ,晶体以分子间作用力结合的是 .
(3)请写出③的电子式 ,⑤的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
|
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣ |
|
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
|
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
|
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
|
| A. | H2SO3>I﹣>Fe2+>NO | B. | I﹣>Fe2+>H2SO3>NO |
|
| C. | Fe2+>I﹣>H2SO3>NO | D. | NO>Fe2+>H2SO3>I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.2mol/L的CuSO4溶液480mL,现配制该溶液,实验操作步骤:
A.用托盘天平称取 gCuSO4•5H2O晶体,放在烧杯中,用适量的蒸馏水使它溶解并恢复至室温.
B.用蒸馏水洗烧杯和玻璃棒2﹣3次,每次洗涤液都小心注入容量瓶,并轻轻振荡
C.继续向容量瓶加蒸馏水,至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切.
D.将制得的溶液通过玻璃棒引流,小心地移至容量瓶中.
E.将瓶塞塞紧,反复上下颠倒,摇匀.
请填写下列空白:
(1)需称 2 gCuSO4•5H2O晶体
(2)操作步骤的正确顺序为 (填序号)
(3)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、药匙,
还缺少的仪器是 、 、 .
(4)下列情况会使所配溶液浓度偏低的是 (填序号)
a.定容时俯视. b.没有进行上述的操作步骤B
c.加蒸馏水时,不慎超过了刻度线 d.砝码上沾有杂质(或者使用生锈的砝码)
e.容量瓶使前未经干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水,则原固体物质的组成是( )
A.Na2O2与Na2O B.Na和NaOH
C.Na2O2和Na D.Na和Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”“小”).
(2)TY2中心原子的杂化方式为 ;XY2中一个分子周围有 个紧邻分子;堆积方式与XY2晶胞类型相同的金属有 (从“Cu、Mg、K、Po”中选出正确的),其空间利用率为 .
(3)Z的第一电离能比Mg的 (填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 .
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是,原因是 .
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T.已知:
XO(g)+1/2O2(g)═XO2(g)△H=﹣283.0kJ•mol﹣1
T(s)+O2(g)═TO2(g)△H=﹣296.0kJ•mol﹣1
此反应的热化学方程式是 .
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方PT晶体结构如下图所示,其晶胞边长为540.0pm,密度为 g•cm﹣3(列式并计算).
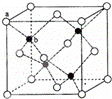
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com