
| A. |  中共面的碳原子最多有13个 中共面的碳原子最多有13个 | |
| B. |  的一氯代物有4种 的一氯代物有4种 | |
| C. | 乙二酸二乙酯与二乙酸乙二酯互为同分异构体 | |
| D. |  由2种单体经过加聚反应合成 由2种单体经过加聚反应合成 |
分析 A.苯分子中六个碳原子和六个氢原子共平面,乙烯6个原子共平面,乙炔四个原子共直线;
B.分子中对称的两个上下六边形中有3种氢原子;
C.分子式相同,结构不同的互为同分异构体;
D. 结构中有三种单体甲醇聚合生成.
结构中有三种单体甲醇聚合生成.
解答 解:A. 分子中结合苯环、乙烯和乙炔结构分析判断,共面的碳原子最多有12个,故A错误;
分子中结合苯环、乙烯和乙炔结构分析判断,共面的碳原子最多有12个,故A错误;
B. 分子中对称的两个上下六边形中有3种氢原子,一氯代物有3种,故B错误;
分子中对称的两个上下六边形中有3种氢原子,一氯代物有3种,故B错误;
C.乙二酸乙二酯、二乙酸乙二酯,分子式相同,结构不同,为同分异构体,故C正确;
D. 结构中有三种单体甲醇聚合生成,分别为
结构中有三种单体甲醇聚合生成,分别为 、
、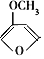 、
、 ,故D错误;
,故D错误;
故选C.
点评 本题考查了有机物分子结构、同分异构体、高聚物单体的判断等,掌握基础是解题关键,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C26 H22 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物的一氯代物有5种 | |
| D. | 该有机物既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 25 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 20 | 0.152 |

查看答案和解析>>
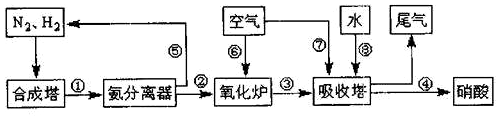
科目:高中化学 来源: 题型:推断题

 ,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.
,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性随原子电子层数的增加而增加 | |
| B. | 在空气中燃烧的生成物都是过氧化物 | |
| C. | 与水反应的剧烈程度随核电荷数增加而增强 | |
| D. | 最高价氧化物对应水化物的碱性随核电荷数增加而增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com