
化学式为C6H12的某烯烃的所有碳原子都在同一平面上,则该烯烃的结构简式为___________________,其名称为______________;在核磁共振氢谱图上应该出现_____个峰。
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
下列化学反应的速率,一定是前者大于后者的( )
|
| A. | 反应A+B |
|
| B. | 相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 |
|
| C. | 相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 |
|
| D. | 一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
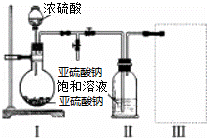
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为 (填序号)

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是 .
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 .
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g•L﹣1.
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 (填“偏高”“偏低”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组有机物的混合物,只有总质量一定,无论按何比例混合,完全燃烧后生成CO2和H2O都不是恒量的是( )
A.C2H4O、C4H8O2 B.C2H4、C3H6
C.C10H8、C9H 20 D.C3H8O3、C7H8
20 D.C3H8O3、C7H8
查看答案和解析>>
科目:高中化学 来源: 题型:
某种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物的结构片断为:
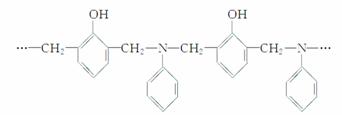
则生成该树脂的单体的种数和化学反应所属类型正确的是( )
A.1种,加聚反应 B.2种,缩聚反应
C.3种,加聚反应 D.3种,缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组以环己醇制备环己烯(如下图),

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
① A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是_________;
②试管C置于冰水浴中的目的是____________________________。
(2)制备精品
① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填字母)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
② 再将环己烯按右图装置蒸馏,冷却水从_________口进入(填字母)。蒸馏时要加入生石灰,目的是___________________;

③ 收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母);
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3) 以下区分环己烯精品和粗品的方法,合理的是_________(填字母)。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
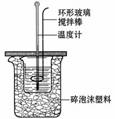
关于中和热测定实验的下列说法不正确的是( )
A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B.使用环形玻璃棒既可以搅拌又避免损坏温度计
C.向盛装酸的烧杯中加碱时要小心缓慢
D.测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
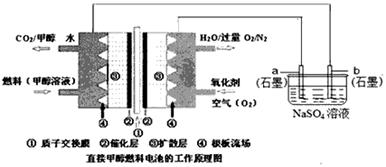
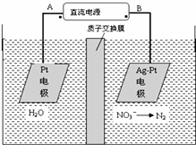 (1)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
(1)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
|
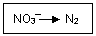 ①直流电源A为 极,阳极反应式为 。
①直流电源A为 极,阳极反应式为 。 ②若电解过程中转移了2mol电子,则电源B端连接的电极产生的标况下的气体体积为 L。




|
②碱性条件下,通入甲醇的一极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:
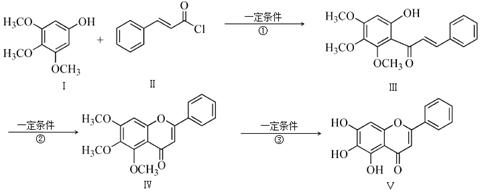
回答下列问题:
(1)化合物Ⅲ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2.
(2)化合物Ⅱ的合成方法为:
|
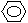 -CHO+(CH3CO)2O →
-CHO+(CH3CO)2O →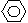
 -CH=CHCOOH+ A
-CH=CHCOOH+ A
 |
|

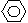
 -CH=CHCOOH 化合物Ⅱ
-CH=CHCOOH 化合物Ⅱ 已知在合成肉桂酸的化学反应中,反应物的物质的量之比为1︰1,生成物A可与饱和NaHCO3溶液反应产生气体,则生成物A的结构简式是 。
(3)反应①的反应类型为 。化合物Ⅰ和Ⅱ反应还可以得到一种酯,生成该酯的反应方程式为 。(不用注明反应条件)
(4)下列关于化合物Ⅳ、Ⅴ的说法正确的是 (填序号)。
a.都属于芳香化合物
b.都能与H2发生加成反应,Ⅳ消耗的H2更多
c.都能使酸性KMnO4溶液褪色
d.都能与FeCl3溶液发生显色反应
(5)满足以下条件的化合物Ⅰ的同分异构体Ⅵ的结构简式为
①遇FeCl3溶液显示紫色
②l mol Ⅵ与浓溴水反应,最多消耗1 mol Br2
③Ⅵ的核磁共振氢谱有五组峰,峰面积之比为1︰1︰2︰2︰6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com