
【题目】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知: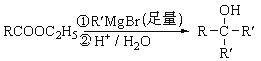
请回答下列问题:
(1)A的分子式为______;G所含官能团的名称是______。
(2)C→D的反应类型为____;该反应的副产物中与D互为同分异构体的化合物的结构简式为______。
(3)E→F反应中加入试剂浓H2SO4的作用是_______;F中混有少量C2H5OH和E,最好用_____(填字母)洗涤除去。
A.水 B.氢氧化钠溶液 C.浓硫酸 D.饱和碳酸钠溶液
(5)B在一定条件下发生聚合反应的化学方程式为______;写出同时满足下列条件的B的链状同分异构体的结构简式________。
①核磁共振氢谱有2个吸收峰。 ②能发生银镜反应。
【答案】 C7H10O3 碳碳双键、羟基 消去反应 ![]() 催化剂、吸水剂
催化剂、吸水剂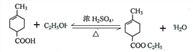 D
D ![]()
![]()
【解析】试题分析:试题以α-萜品醇G的合成为线索,考查有机物的分子式、结构简式、官能团、有机反应原理、有机反应类型、除杂方案、同分异构体等知识点,考查考生对有机流程的分析能力和利用已有知识解决问题的能力。
解析:α-萜品醇G的合成流程中,根据反应条件可知,B→C是醇与HBr的取代反应,C为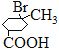 ,C→D是消去反应,同时—COOH与碱发生中和,D为
,C→D是消去反应,同时—COOH与碱发生中和,D为![]() ,D酸化得到E,E为
,D酸化得到E,E为![]() ,E与乙醇发生酯化反应生成的F为
,E与乙醇发生酯化反应生成的F为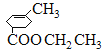 ,结合已知中酯发生的反应及产物G的结构,则已知反应的反应物及产物中R′是—CH3,所以Y为CH3MgBr。(1)A的分子式为C7H10O3,G分子中官能团是C=C和—OH,名称是碳碳双键和羟基。正确答案:C7H10O3、碳碳双键 羟基。(2)C→D是卤代物在NaOH乙醇溶液中加热发生消去反应,同时—COOH与碱发生中和,卤原子邻位C原子有两种,六元环上的两个位置是等价的,另外一种是在—CH3上消去H原子生成
,结合已知中酯发生的反应及产物G的结构,则已知反应的反应物及产物中R′是—CH3,所以Y为CH3MgBr。(1)A的分子式为C7H10O3,G分子中官能团是C=C和—OH,名称是碳碳双键和羟基。正确答案:C7H10O3、碳碳双键 羟基。(2)C→D是卤代物在NaOH乙醇溶液中加热发生消去反应,同时—COOH与碱发生中和,卤原子邻位C原子有两种,六元环上的两个位置是等价的,另外一种是在—CH3上消去H原子生成![]() 。正确答案:消去反应、
。正确答案:消去反应、![]() 。(3)E→F是酯化反应,浓硫酸在反应中做催化剂和吸水剂。F中混有的C2H5OH和E时,A、水虽然可以溶解乙醇,但是E、F能够互溶,所以不能除去有机物E;B、NaOH能够使F发生水解,也不合适 。C、由于酯化反应是可逆反应,浓硫酸 不能使反应完全进行,C错误。D、饱和碳酸氢钠溶液可以溶解乙醇,并使E反应生成可溶性钠盐而与F分离,再用分液即可分离出F,D正确。正确答案:催化剂和吸水剂、D。(5)B的聚合是—OH与—COOH 的缩聚反应,反应原理为
。(3)E→F是酯化反应,浓硫酸在反应中做催化剂和吸水剂。F中混有的C2H5OH和E时,A、水虽然可以溶解乙醇,但是E、F能够互溶,所以不能除去有机物E;B、NaOH能够使F发生水解,也不合适 。C、由于酯化反应是可逆反应,浓硫酸 不能使反应完全进行,C错误。D、饱和碳酸氢钠溶液可以溶解乙醇,并使E反应生成可溶性钠盐而与F分离,再用分液即可分离出F,D正确。正确答案:催化剂和吸水剂、D。(5)B的聚合是—OH与—COOH 的缩聚反应,反应原理为![]() 。B分子式是C8H14O3,不饱和度为2,能够发生银镜反应说明含有—CHO,链状结构不存在环,如果再有一个碳碳双键,由于对称性较差,核磁共振氢谱吸收峰最少的结构吸收峰数目也大于2,不符合。所以应当含有两个—CHO,对称性最好的结构是
。B分子式是C8H14O3,不饱和度为2,能够发生银镜反应说明含有—CHO,链状结构不存在环,如果再有一个碳碳双键,由于对称性较差,核磁共振氢谱吸收峰最少的结构吸收峰数目也大于2,不符合。所以应当含有两个—CHO,对称性最好的结构是![]() ,核磁共振氢谱有2个吸收峰。正确答案:
,核磁共振氢谱有2个吸收峰。正确答案:![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】环境污染问题越来越受到人们的关注,造成环境污染的主要原因是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A. 温室效应——CO2 B. 光化学污染——NO2
C. 酸雨——SO2 D. 臭氧层破坏——CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100 ml 的氯气。(常温下,氯气的密度为2.91g/L。)
(1)写出制取氯气的离子方程式。
(2)制取4瓶氯气,理论上需要MnO2固体的质量是多少?
(3)制取4瓶氯气,被氧化的HCl的物质的量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是

A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+Y2(g)![]() 2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL-1、0.3molL-1、0.2molL-1,反应达到平衡时,各物质浓度可能是 ( )
2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL-1、0.3molL-1、0.2molL-1,反应达到平衡时,各物质浓度可能是 ( )
A.c(X)=0.2molL-1 B.c(Y2)=0.35molL-1 C.c(Y2)=0.2molL-1 D.c(Z)=0.4molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
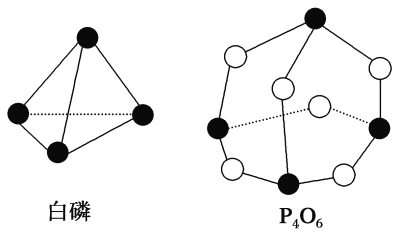
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为( )
A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol · L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol · L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是

A. 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B. 点③时:c(Na+)=c(CH3COO-)>c(H+)
C. 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(6)实验时所用盐酸及NaOH溶液的密度均为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com