
| 铵盐的质量/g | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量/g | m | m | 1.29 | 0 |
 =1.8mol,因此在标准状况下的体积是1.8mol×22.4L/mol=40.32L。
=1.8mol,因此在标准状况下的体积是1.8mol×22.4L/mol=40.32L。 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O ×2×17g/mol+
×2×17g/mol+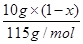 ×17g/mol=mg ①
×17g/mol=mg ①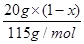 ]×17g/mol=mg ②
]×17g/mol=mg ②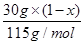 ]×17g/mol=1.29g ③
]×17g/mol=1.29g ③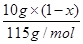 ×2×14g/mol+
×2×14g/mol+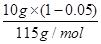 ×14g/mol=1.67g
×14g/mol=1.67g

科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二者遇水都能剧烈反应 | B.二者在自然界中都以化合态存在 |
| C.钠钾合金常温下是液体 | D.钾能从氯化钠溶液中置换出钠单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
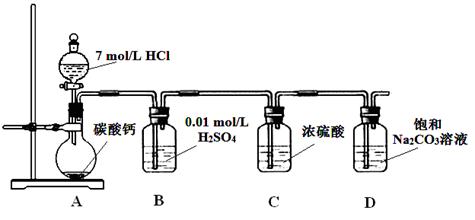
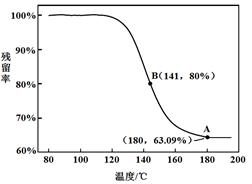

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.④③②① | C.②③④① | D.①③④② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaHCO3的俗称是苏打 |
| B.Na2CO3溶液显碱性,说明Na2CO3属于碱 |
| C.相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 |
| D.向Na2CO3和NaHCO3固体中分别滴加等浓度的盐酸,后者反应速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com