
| A. | 温度升高,反应速率增大,产率增大 | |
| B. | 增大反应物H2的浓度,HI%增大 | |
| C. | 增大压强,浓度增大,平衡不移动 | |
| D. | 使用催化剂,反应速率增大,I2的转化率增大 |
分析 A.该反应为放热反应,升高温度平衡逆向移动;
B.若减小体积增大浓度,平衡不移动;
C.增大压强,体积减小,平衡不移动;
D.催化剂对平衡移动无影响.
解答 解:A.该反应为放热反应,升高温度平衡逆向移动,则反应速率增大,产率减小,故A错误;
B.若减小体积增大浓度,平衡不移动,则HI%不变,故B错误;
C.该反应为气体体积不变的反应,增大压强,体积减小,浓度增大,平衡不移动,故C正确;
D.催化剂对平衡移动无影响,则使用催化剂,反应速率增大,I2的转化率不变,故D错误;
故选C.
点评 本题考查化学平衡移动,为高频考点,把握温度、压强、浓度对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:V2O4+xe-+xLi+=LixV2O4 | |
| B. | 该充电宝的凝胶介质也可用KOH溶液代替 | |
| C. | 充电时电池的正极得到电子后LixV2O4转化为V2O4 | |
| D. | 放电时每消耗7gLi,就会有1mol电子通过凝胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4NO3 | D. | NH4NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
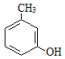 +CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$
+CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$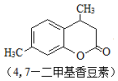 +C2H5OH+H2O
+C2H5OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com