
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;能构成原电池,观察到有电流产生,据此判断分析.
解答 解:A.两个电极为同种金属,不满足构成原电池的条件,所以不能构成原电池,故A错误;
B.Zn作负极,Ag为正极,正极上氢离子得电子,该装置符合原电池构成条件,所以能构成原电池,能产生电流,故B正确;
C.酒精属于非电解质,不满足构成原电池的条件,所以不能构成原电池,故C错误;
D.该装置不能自发进行氧化还原反应,不满足构成原电池的条件,所以不能构成原电池,故D错误;
故选B.
点评 本题考查了原电池的判断,题目难度不大,根据原电池的构成条件及工作原理判断即可,侧重于考查对基础知识的应用能力.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
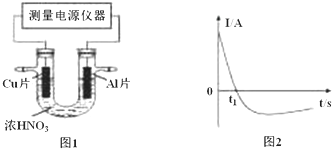
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
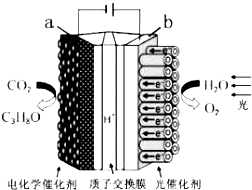 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成3mol O2,有44.8LCO2被还原 | |
| D. | a电极的反应为:3CO2+16H+-18e-=C3H8O+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
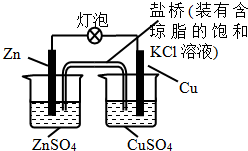
| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-=Zn2+ | |
| C. | 在外电路中,电流从锌棒流向铜棒 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: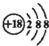 | |
| B. | NaClO的电子式: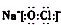 | |
| C. | 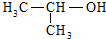 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$ I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 平衡时气体平均相对分子质量约为23.3 | |
| D. | 其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com