
【题目】环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:

回答以下问题:
(1)A属于烯烃,其结构简式为________。
(2)B→C的反应类型是________,该反应生成的与C互为同分异构体的副产物是________(写结构简式)。
(3)D的结构简式为________,E的化学名称是________。
(4)写出同时满足下列条件的G的所有同分异构体__________(写结构简式,不考虑立体异构)。
① 核磁共振氢谱为3组峰;
② 能使溴的四氯化碳溶液褪色;
③ 1mol该同分异构体与足量饱和NaHCO3反应产生88g气体。
(5)H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式________。
(6)参照上述合成路线,以![]() 和化合物E为原料(无机试剂任选),设计制备
和化合物E为原料(无机试剂任选),设计制备![]() 的合成路线:________。
的合成路线:________。
【答案】 CH2=CH-CH3 加成反应 ![]() HOOC-CH2-COOH 丙二酸二乙酯 HOOC-CH2-CH=CH-CH2-COOH 、 CH2=C(CH2-COOH)2
HOOC-CH2-COOH 丙二酸二乙酯 HOOC-CH2-CH=CH-CH2-COOH 、 CH2=C(CH2-COOH)2 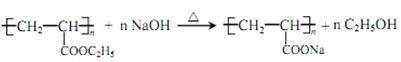

【解析】用逆合成分析法:由C的结构可推出B为CH2=CH-CH2Br,A为CH2=CH-CH3。
(1)由上述分析,A与Br2光照条件下取代反应生成B,B与HBr加成反应生成C,A属于烯烃,则为丙烯,其结构简式为CH2=CH-CH3。
(2)CH2=CH-CH2Br与HBr发生加成反应生成CH2Br-CH2-CH2Br,故B→C的反应类型是:加成反应;该反应生成的与C互为同分异构体的副产物是:CH3-CHBr-CH2Br。
(3)D与E发生酯化反应生成F,由E的结构简式可推出D为丙二酸,结构简式为HOOC-CH2-COOH;E的化学名称是丙二酸二乙酯。
(4)G为![]() ,其同分异构体:①核磁共振氢谱为3组峰;则有3种氢原子。②能使溴的四氯化碳溶液褪色;则有碳碳双键。③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体;则分子中有2个羧基。综上,结构简式为:HOOC-CH2-CH=CH-CH2-COOH、CH2=C(CH2-COOH)2两种。
,其同分异构体:①核磁共振氢谱为3组峰;则有3种氢原子。②能使溴的四氯化碳溶液褪色;则有碳碳双键。③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体;则分子中有2个羧基。综上,结构简式为:HOOC-CH2-CH=CH-CH2-COOH、CH2=C(CH2-COOH)2两种。
(5)丙烯酸乙酯(CH2=CH—COOC2H5)发生加聚反应生成聚丙烯酸乙酯(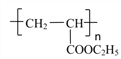 ),聚丙烯酸乙酯在NaOH溶液中水解的化学方程式为:
),聚丙烯酸乙酯在NaOH溶液中水解的化学方程式为: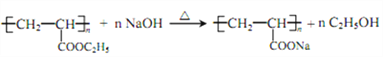 。
。
(6)以![]() 和化合物E(丙二酸二乙酯)为原料,制备
和化合物E(丙二酸二乙酯)为原料,制备![]() ,根据逆合成分析法,制备
,根据逆合成分析法,制备![]() ,需要
,需要![]() ;
;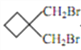 和
和![]() (丙二酸二乙酯)反应生成
(丙二酸二乙酯)反应生成![]() ;
;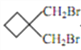 可由
可由![]() 与HBr取代生成,故合成路线为:
与HBr取代生成,故合成路线为: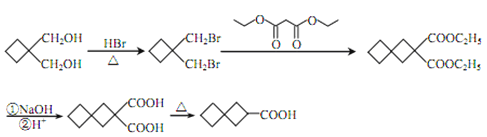 。
。


科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是

A. 200℃时,反应从开始到平衡的平均速率v(A)=0.08molL-1min-1
B. 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆)
C. 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)![]() C(g) ΔH= +5m kJ/mol
C(g) ΔH= +5m kJ/mol
D. 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制500 mL 0.5 mol/L NaOH溶液。
(1)该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管、烧杯___________。
(2)其操作步骤如乙图所示,则甲图操作应在乙图中的 ____ (填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥


(3)该同学应称取NaOH固体 ___ g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
附表:砝码规格

a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
并在下图中选出能正确表示游码位置的选项 ____ (填大写字母)。



该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是 ____ (填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是( )
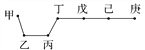
A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物的水化物可以相互反应
D. 庚的最高价氧化物的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
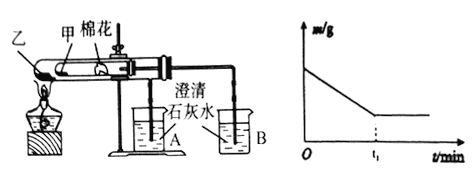
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:LaC13+6NH4HCO3= La2(CO3)3↓+6NH4Cl+ 3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
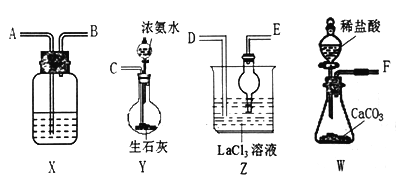
(l)盛放稀盐酸的仪器为____________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→___→___ →___ →___ →___ 。
(3)Y中发生反应的化学反应式为________________。
(4)X中盛放的试剂是_____,其作用为________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________。
(6)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mLNH3 —NH4Cl缓冲溶液,加入0.2g紫脲酸铵混合指示剂,用0.5mol/LEDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y-=LaY-+2H+),消耗EDTA 溶液44.0 mL。则产品中La2(CO3)3的质量分数ω[La2(CO3)3]=_________。
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为_______;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com