
【题目】为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:
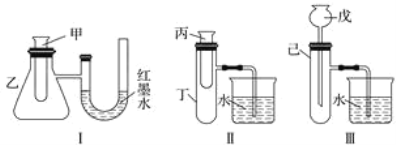
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是________(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是_________________________________。说明该反应属于________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
【答案】Ⅲ 左端液面降低,右端液面升高 放热 产生气泡,反应完毕后,冷却至室温,烧杯中的导管内形成一段水柱 可能是放热反应 某些物质(如NaOH固体)溶于水放热,但不是放热反应 Ⅰ(或Ⅱ) 放热
【解析】
(1)装置Ⅰ和Ⅱ都可以分别通过右边装置中液面变化、是否有气泡判断反应是吸热还是放热,而装置Ⅲ是将生成的气体直接通入水中,无法判断该反应是吸热还是放热反应;
(2)酸碱中和反应为放热反应,反应放出的热使锥形瓶中温度升高,气体体积增大,据此判断U型管中液面的变化;
(3)钠与水的反应为放热反应,温度升高导致大试管中气体受热压强增大,烧杯中有气泡产生,冷却后体积减小,压强减小,导管中会形成水柱;M溶于水放出热量,不一定为化学变化,则不一定属于放热反应;
(4)利用装置Ⅰ或Ⅱ都可以验证该反应为放热反应;棉花燃烧,证明反应中放出大量热,该反应为放热反应。
(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热。装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应;
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U型管左端液柱降低,右端液柱升高;
(3))①若M为钠,钠与水反应生成氢氧化钠和氢气,该反应为放热反应,放热的热量使大试管中温度升高,气体压强增大,所以右边烧杯中有气泡产生,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱;
②若观察到烧杯里产生气泡,说明M溶于水放出热量,由于放热反应一定属于化学变化,而有热量放出的反应不一定为化学变化,所以不一定属于放热反应,如浓硫酸溶于水会放出热量,但是不属于放热反应;
(4)证明超氧化钾与水的反应是放热反应还是吸热反应:方法①:选择上述装置Ⅰ(或Ⅱ)进行实验,Ⅰ装置右边U型管中左端液柱降低,右端液柱升高(或烧杯中导管中有气泡放出),证明该反应为放热反应;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应放出大量热,使棉花燃烧,证明该反应是放热反应。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是
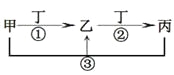
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+O2(g)![]() 2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
A.恒容,按原平衡各物质的比例充入N2、O2和NOB.恒容,充入He
C.恒压,充入HeD.恒压,充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2和Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的体积关系如图所示,则原溶液中MgCl2和Al2(SO4)3的物质的量浓度之比为( )
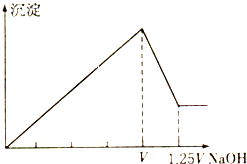
A. 1:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
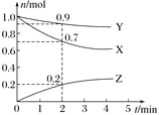
A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min后达到化学平衡,此时C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1 min-1。
3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min后达到化学平衡,此时C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1 min-1。
(1)5 min末B的物质的量浓度为________。
(2)前5 min内化学反应速率v(A)为_______。
(3)化学方程式中n值为________。
(4)该反应在此温度下的平衡常数K=______(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质。它们之间有如下转化关系:

化合物D也是生活中常见的化合物,在一定条件下可发生如下反应:D+3甲![]() 3A+2B
3A+2B
请回答下列问题:
(1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。
(2)在常温下,A和B通过__________转化为C。该过程的能量转化关系如何?
____________________。
(3)写出由C生成D的反应的化学方程式____________________。
(4)化合物C是人类生命活动不可缺少的物质之一,它在血液中的正常含量是__________。
(5)目前化合物B在大气中含量呈上升趋势,对环境造成的影响是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com