
【题目】下列关于有机物1-氧杂-2,4-环戊二烯(![]() )的说法正确的是()
)的说法正确的是()
A.![]() 与
与![]() 互为同系物
互为同系物
B.一氯代物有2种,二氯代物有4种(不考虑立体异构)
C.能使溴水退色,不能使酸性高锰酸钾溶液退色
D.1mol该有机物完全燃烧消耗5molO2
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是 ( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L 的密闭容器中,X、Y、Z 三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
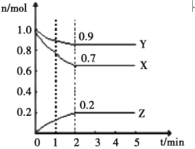
(1)2min时,Y 的物质的量浓度是____________;
(2)从开始至2min,X 的平均反应速率为_________;
(3)该反应的化学方程式为____________________;
(4)1min时,v(正)____v(逆),2min时,v(正)____v(逆) (填“>”或“<”或“=”);
(5)在2min时,向容器中通入氩气,增大体系压强,X 的化学反应速率将______;
(6)2min时,x的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
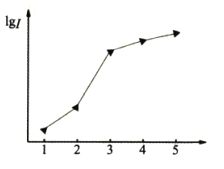
【题目】元素的性质与原子结构、元素在周期表中的位置有着密切的关系。回答下列问题:
(1)如图表示某短周期元素X的前五级电离能(I)的对数值,试推测并写出X的元素符号___。
(2)化合物甲与SO2所含元素种类相同,两者互为等电子体,请写出甲的化学式___,甲分子中心原子的杂化类型是___。
(3)配位化学创始人维尔纳发现,将1mo1CoC13·5NH3(紫红色)和1mo1CoC134NH3(绿色)溶于水,加入AgNO3溶液,立即沉淀的AgCl分别为2mo1、1mol。则紫红色配合物中配离子的化学式为___,绿色配合物中Co的配位数为___。
(4)某稀土元素M的氧化物晶体为立方晶胞,其结构如图所示,图中小球代表氧离子,大球代表M离子。
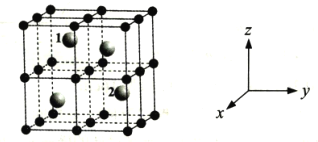
①写出该氧化物的化学式___。
②己知该晶体密度为ρg·cm-3,晶胞参数为anm,NA为阿伏加德罗常数的值。则M的相对原子质量Mr=___(用含ρ、a等的代数式表示);
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1(M原子)的坐标为(![]() ,
,![]() ,
,![]() ),则原子2(M原子)的坐标为___。
),则原子2(M原子)的坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LSO2溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.分子式为C2H6O的某种有机物4.6g,含有C-H键的数目一定为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
B. H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央
C. CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
D. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
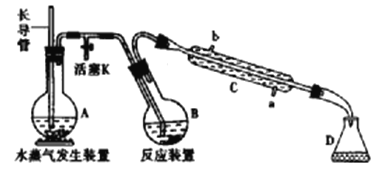
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL一定浓度的硝酸银溶液中,逐滴加入0.1mol·L-1的氨水,反应过程中-1gc(Ag+)或-1gc[Ag(NH3)2+]与加入氨水体积的关系如图。下列说法错误的是( )
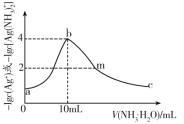
A.原硝酸银溶液的浓度是0.1mol·L-1
B.反应生成氢氧化银的Ksp(AgOH)的数量级为10-8
C.溶液b点NH4+的浓度小于溶液c点NH4+的浓度
D.溶液m点c(NO3-)>c(Ag+)+c[Ag(NH3)2+]+c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com