
【题目】(1)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的FeCl3溶液,继续煮沸,待溶液呈红褐色停止加热。
①写出该反应方程式________________________________________。
②证明该分散系是胶体最简单的实验操作名称________________________。
(2)对于反应2CO+O2=2CO2,在标准状况下,4.48 L一氧化碳与足量的氧气发生反应,生成的二氧化碳分子个数是__________________。
(3)现有一种泉水样品,1.0 L这种泉水含有4.8×10-2 g Mg2+。那么,该泉水中Mg2+的物质的量浓度是_______________,含1.0 mol Mg2+的这种泉水的体积是_______________。
【答案】FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 丁达尔效应 0.2NA或者1.204×1023 2×10-3mol·L-1 500 L
Fe(OH)3(胶体)+3HCl 丁达尔效应 0.2NA或者1.204×1023 2×10-3mol·L-1 500 L
【解析】
(1)①用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的FeCl3溶液,继续煮沸,待溶液呈红褐色停止加热,此时得到的是氢氧化铁胶体,反应的方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
②胶体能产生丁达尔效应,则证明该分散系是胶体最简单的实验操作名称是丁达尔效应。
(2)对于反应2CO+O2![]() 2CO2,在标准状况下,4.48 L一氧化碳与足量的氧气发生反应,根据方程式可知生成的二氧化碳是4.48L,物质的量是4.48L÷22.4L/mol=0.2mol,分子个数是0.2mol×6.02×1023/mol=1.204×1023。
2CO2,在标准状况下,4.48 L一氧化碳与足量的氧气发生反应,根据方程式可知生成的二氧化碳是4.48L,物质的量是4.48L÷22.4L/mol=0.2mol,分子个数是0.2mol×6.02×1023/mol=1.204×1023。
(3)现有一种泉水样品,1.0 L这种泉水含有4.8×10-2 g Mg2+,物质的量是0.048g÷24g/mol=0.002mol,因此该泉水中Mg2+的物质的量浓度是0.002mol÷1L=2×10-3mol·L-1,含1.0 mol Mg2+的这种泉水的体积是1mol÷0.002mol/L=500L。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)简述氢氧化铁胶体的制备方法______________________________ 。
(2)用Na2CO3·10H2O晶体配制0.10 mol/L Na2CO3溶液480 mL。
①实验时要用到的仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___________________,在使用该仪器前必须进行 的操作是_____________,在萃取实验中也需要该操作的仪器是_____________;
②用托盘天平称取Na2CO3·10H2O晶体的质量为___________g;
③配制溶液时有以下几个操作:
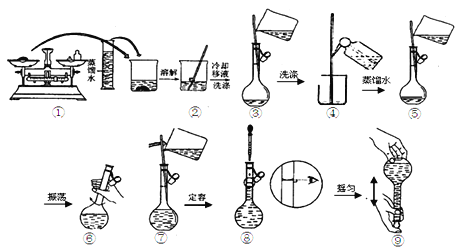
配制过程中,下列操作对所配溶液的浓度有什么影响,完成填空。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
会引起所配溶液的浓度偏大的有________,无影响的有________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
①流程中先加双氧水的目的是__________________________________________。
②加氨水调节溶液的pH等于6,则滤渣的成分是__________________,滤液中含有的阳离子有H+ 和___________________。
(3)在浸出液里锰元素只以Mn2+ 的形式存在,且滤渣中也无MnO2,请解释原因_________。
(4)阴离子膜法电解装置如右图所示,电解装置中箭头表示溶液中阴离子移动的方向,则A电极是______极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__________________________。

(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓HNO3与浓H2SO4的叙述正确的是( )
A.常温下遇铁都发生钝化B.常温下都能与铜反应产生氢气
C.露置于空气中,溶液质量均不变D.露置于空气中,溶液浓度均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表和周期律的相关知识,下列说法正确的是( )
A.短周期元素中,原子最外层只有一个或两个电子的元素一定是金属元素
B.I属于副族元素
C.H2S的稳定性比H2O的稳定性强
D.Na、Mg、Al与冷水反应速率逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:

反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。

①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
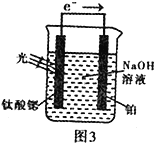
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e-![]() O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知: ① Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O ② SO2+SeO2+ H2O ![]() Se + SO42-+ H+
Se + SO42-+ H+
(1)依据Se与浓H2SO4的反应,写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:__________________。
(2)Se与浓HNO3的反应中,氧化剂是_______, 反应中被还原的元素是_______。当有标准状况下33.6LNO2气体生成时,转移电子的物质的量是________mol。
(3)依据反应①②, 判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是__________。
(4) 配平反应②, 并用双线桥法标出电子转移的方向和数目:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com