
| A. | CH3-(CH2)11C6H4-SO3Na | B. | CH3-(CH2)13-COOK | ||
| C. | CH3-(CH2)11-SO3Na | D. | CH3(CH2)nCH3(5≤n≤12) |
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 ;
;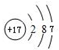 ;④电子式表示A和B元素组成的化合物的形成过程:
;④电子式表示A和B元素组成的化合物的形成过程: .
.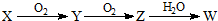
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
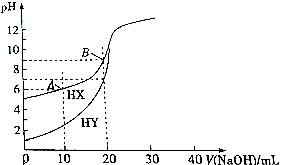
| A. | 相同条件下,HX和HY中和碱的能力相同 | |
| B. | 常温下,HX的电离平衡常数K=1×10-9mol•L-1 | |
| C. | 点存在:c(X-)-c(HX)>c(H+)-c(0H-) | |
| D. | 向B点溶液通人HCl气体至中性:c(HX)+c(Cl-)+2c(X-)=0.2mol•L-1A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+=2Mn2++4O2↑+6H2O | |
| B. | HClO4的电离方程式:HClO4=H++ClO4- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | Fe2+被空气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
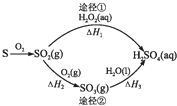
| A. | 已知S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,则S(s)+O2(g)═SO2(g)反应放出的热量小于293.23 kJ/mol | |
| B. | 含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△H1<△H2+△H3,则2H2O2(aq)═2H2O(l)+O2(g)为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
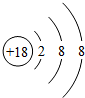 ;
; ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl晶体中少量KNO3,可以将混合物制成热的饱和溶液,然后冷却结晶,过滤,洗涤,干燥 | |
| B. | 在食醋总酸含量测定实验中,配制NaOH标准溶液后需要用邻苯二甲酸氢钾对该溶液浓度进行标定 | |
| C. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径.工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| D. | 在洁净试管中加入2mL 10% NaOH溶液,再加入等量的CuSO4溶液,制得的新制氢氧化铜悬浊液可用于检验糖尿病人尿液中葡萄糖含量是否偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com