
| A. | 石墨与O2反应 | B. | 硫磺与O2反应 | ||
| C. | 闪电时,氮气与O2反应 | D. | 硅在足量的O2中燃烧 |
分析 A.石墨成分为碳单质,和氧气的反应是不充分反应生成一氧化碳,充分燃烧生成二氧化碳;
B.硫和氧气点燃反应生成二氧化硫;
C.闪电时氮气和氧气反应生成一氧化氮气体;
D.硅在足量氧气中燃烧生成二氧化硅.
解答 解:A.石墨成分为碳单质,和氧气的反应是不充分反应生成一氧化碳,2CO+O2=2CO2,充分燃烧生成二氧化碳C+O2=CO2,产物不一定是最高价氧化物,故A错误;
B.硫和氧气点燃反应生成二氧化硫,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,二氧化硫中硫元素化合价为+4价,不是最高价,故B错误;
C.闪电时氮气和氧气反应生成一氧化氮气体,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,生成的一氧化氮中氮元素化合价为+2价,不是氮元素的最高价,故C错误;
D.硅在足量氧气中燃烧生成二氧化硅,Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2,生成的二氧化硅中硅元素化合价为+4价,为碳元素的最高化合价,故D正确;
故选D.
点评 本题考查了物质性质的理解应用,主要是生成产物中的元素化合价变化,注意反应条件和产物的判断,注意知识积累,题目较简单.


科目:高中化学 来源: 题型:解答题
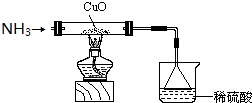
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LBr2所含溴原子的数目为2NA | |
| B. | 常温下,NO2与足量的水反应生成0.1molNO,转移的电子数为0.2NA | |
| C. | 1 mol 乙醇中含有的C-H键的数目为6NA | |
| D. | 1mol•L-1的NaClO溶液中含有的ClO-数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极和阳极的质量始终保持不变 | |
| B. | 溶液中的Cu2+、H+和Na+都要移向阴极,但在阴极优先放电的离子是Cu2+ | |
| C. | 溶液中的Cl-在阳极上完全放电后,溶液中的SO${\;}_{4}^{2-}$接着在该极上放电生成O2 | |
| D. | 电解过程中阴极上始终有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶液中c(Cl-)=c(NH4+),则溶液一定呈中性 | |
| B. | 若c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶质一定为NH4Cl | |
| C. | 若c(OH-)>c(H+),则溶液中不可能存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若溶质为NH4Cl、NH3•H2O,则一定存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NO2):V(O2)=2:1 | B. | V(NO):V(O2)=2:1 | ||
| C. | V(NH3):V(O2)=2:1 | D. | V(NO2):V(NO):V(O2)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ | |
| D. | AgNO3溶液中加入过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
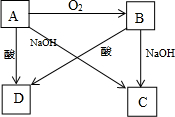
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCLO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
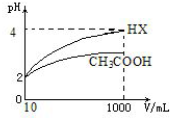
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com