
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的
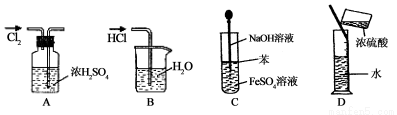
A.干燥Cl2 B.吸收HCl
C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:选择题
将下图中所示实验装置的K闭合,下列判断正确的是
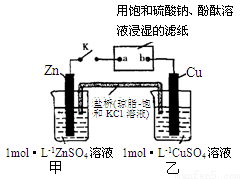
A.电子沿Zn→a→b→Cu路径流动
B.Cu电极上发生氧化反应
C.甲池与乙池中的溶液互换,闭合K仍有电流产生
D.片刻后可观察到滤纸a点变红色
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:填空题
(8分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________ 。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2 B.Fe C.H2O2 D.HNO3
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
分类是化学学习与研究的常用方法,下列分类正确的是
A.Na2O2、MgO、Al2O3均属于碱性氧化物
B.纯碱、烧碱、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示

查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
大胆科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是
A.探究SO2与Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能生成NaOH和H2O2
C.探究浓H2SO4与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性变化所致,还是HClO的漂白性
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
下列说法正确的是
A.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
B.不能用瓷坩埚加热熔融氢氧化钠固体
C.将SO2通入品红溶液或溴水均能使它们褪色,证明SO2有漂白性
D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
(12分)A+B→X+Y+ H2O(为配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是______.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol.
(4)若A、B、X、Y均为化合物.A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则向A中逐滴加入B的离子方程式 .
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A、我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B、需要通过化学反应才能从海水中获得食盐和淡水
C、水晶项链和餐桌上的瓷盘都是硅酸盐制品
D、粗硅制备单晶硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届山东省烟台市高三上学期期中考试化学试卷(解析版) 题型:选择题
某短周期非金属元素R的原子核外最外层电子数是次外层电子数的一半,有关该元素的下列说法正确的是
A.在自然界中只以化合态的形式存在
B.RO32-所含电子数比NO3-的电子数多7
C.最高氧化物能与水反应生成含氧酸
D.气态氢化物比CH4稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com