
һ���¶��µ��ܱ������д������·�Ӧ��
CO(g)+H2O(g) CO2(g)+
H2(g)����֪CO(g)��H2O(g)����ʼŨ�Ⱦ�Ϊ2 mol��L-1�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K =1�����жϣ�
CO2(g)+
H2(g)����֪CO(g)��H2O(g)����ʼŨ�Ⱦ�Ϊ2 mol��L-1�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K =1�����жϣ�
(1)��COת����Ϊ25%ʱ���÷�Ӧ�Ƿ�ﵽƽ��_______����δ�ﵽƽ�⣬���ĸ��������______��
(2)�ﵽƽ��ʱ��CO��ת����____________________��
(3)��CO����ʼŨ����Ϊ2 mol��L-1��H2O(g)����ʼŨ��Ϊ6 mol��L-1����ƽ��ʱCO��ת����_______��
(1)��Ӧδ��ƽ�� Q=1�M9<K=1,ƽ��������Ӧ������С�(2)50�G (3) 75�G��
��������
���������(1)��COת����Ϊ25%ʱ��{C(CO2)C(H2)}�M{C(CO)C(H2O)}=��0��5��0��5���M��1��5��1��5��=1�M9<1�����Է�Ӧδ�ﵽƽ�⡣��Ӧ������Ӧ������С�����Ӧ�ﵽƽ��ʱ���������ĵ�COŨ��Ϊx�����ݷ�Ӧ����ʽ�и����ʵĹ�ϵ�ɵ�X2�M(2-X)2=1�����X=1, COת����Ϊ��1�M2����100�G=50�G��(3)���������������£��ﵽƽ��ʱCO������a mol��L-1����ƽ��ʱ�����ʵ�Ũ��ΪC��CO��=��2- a��mol��L-1 C��H2O��=��6-a��mol��L-1C��CO2��=amol��L-1C��H2��=amol��L-1�� a2�M{��2- a������6-a��}=1���a=1��5������CO��ת����Ϊ: (1��5�M2) ��100�G=75�G��
���㣺���黯ѧƽ����жϼ���Ӧ��ת���ʵļ���ȵ�֪ʶ��


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 H2CO3+OH-
H2CO3+OH- H2CO3+OH-
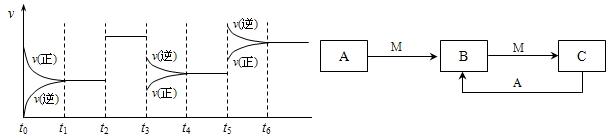
H2CO3+OH- 2SO3��H��0����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ������������˵������ȷ����
2SO3��H��0����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ������������˵������ȷ���� 2SO3�ﵽƽ���SO3���������Ϊ a%��SO2��ת����Ϊm��
2SO3�ﵽƽ���SO3���������Ϊ a%��SO2��ת����Ϊm�� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��A���������ٷ����仯 | B���������������ʵ������ٷ����仯 | C��C�ķ�����Ŀ���ٷ����仯 | D��D�����ʵ���Ũ�Ȳ��ٷ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| t/s | 0 | 500 | 1 000 |
| [H2]/mol?L-1 | 5.00 | 3.52 | 2.48 |
| [CO]/mol?L-1 | 2.50 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com