
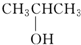 ⑨${\;}_{6}^{13}$C (填序号)
⑨${\;}_{6}^{13}$C (填序号) 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
 有机物A、B、C均由C、H、0三种元素组成,且均满足$\frac{m(C)+m(H)}{m(O)}$=$\frac{7}{8}$,其相对分子质量A<B<C<100,A~I均为有机物,它们之间存在如图所示的转化关系,下列说法正确的是( )
有机物A、B、C均由C、H、0三种元素组成,且均满足$\frac{m(C)+m(H)}{m(O)}$=$\frac{7}{8}$,其相对分子质量A<B<C<100,A~I均为有机物,它们之间存在如图所示的转化关系,下列说法正确的是( )| A. | 有机物A和E含有相同的官能团 | |
| B. | H加入足量澄清石灰水中,能使澄清石灰水变浑浊 | |
| C. | 有机物F的系统命名为乙二酸乙二酯 | |
| D. | 某芳香烃的相对分子质量为B的2倍,其一氯代物有两种,则该烃二氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存 | |
| B. | (NH4)2SO3、Ca(HCO3)2、NaAlO2均既能和稀硫酸又能和氢氧化钠溶液反应 | |
| C. | Fe(OH)3、FeCl2、FeCl3均可通过化合反应得到 | |
| D. | 制备Fe(OH)2时加苯液封,同时将滴管插入苯层液面以下,其目的是防止Fe(OH)2被空气氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.
除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.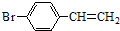 )需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.
)需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成. .
.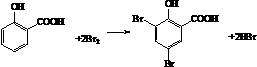 .
.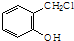 制备A的合成路线
制备A的合成路线查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Hg(l)+H2SO4(aq)=HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,平衡后增大压强,平衡会正向移动,$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$值增大 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
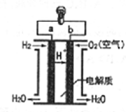
| A. | b极是负极 | B. | 正极发生氧化反应 | ||
| C. | a极的电极反应是H2-2e-=2H+ | D. | 该电池工作时,有淡蓝色火焰产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com