
某同学用回收的镁铝合金制取氢气。现有10.8g镁铝合金,下列说法正确的是( )
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6molH2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45molH2
C.常温下与足量2mol/LH2SO4反应,放出H2的量在0.45mol~0.6mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45mol~0.6mol之间
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届山西省等五校高三上学期第一次联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值,下列有关叙述正确的是
A.高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H—H键3NA
B.46 g Na与0.5 L 2 mol·L-1盐酸充分反应,转移电子数为2NA
C.8.4 g固体NaHCO3中,含有阳离子0.2NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上开学测化学试卷(解析版) 题型:选择题
已知:2CO2+2Na2O2=2Na2CO3+O2,在密闭容器中,将6.6gCO2与一定量的Na2O2固体充分反应后,气体变为3.8g。下列说法正确的是()
A.3.8g气体全部是O2
B.3.8g气体通过足量NaOH溶液后,气体减少2.2g
C.反应后的固体是混合物
D.生成Na2CO3的质量为15.9g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:填空题
(1)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥Ba(OH)2·H2O与NH4Cl,属于放热反应__________(填序号),写出反应⑥的化学方程式______________。
(2)在下列化合物中: H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
① 只由非金属组成的离子化合物是___________;
② 只有极性共价键的共价化合物是____________;
③ 只含有非极性共价键的是__________________;
④ 既有离子键又有非极性键的化合物是__________;
⑤ 写出NH4Cl的电子式______________;
⑥写出Na2O2的电子式______________。
(3)某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
①写出实验①中发生反应的离子方程式:_______________________。
②实验②的化学反应中转移电子的物质的量是________________。
③以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:选择题
某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经侧定ClO-和ClO3-的浓度之比为l : 3 ,则Cl2与NaoH 溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比( )
A.21:5 B.11:3 C.3:1 D.4:l
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:实验题
由几种离子化合物组成的混合物,含有以下离子中的若干种: K+、Cl-、NH4+、Mg2+、Ba2+、CO3-、SO42-,将该混合物溶于水后得澄清溶液,现取3份各100mL的该溶液分别进行如下实验:

试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度/mol·L-1 |
(3)试确定K+是否存在并说明理由。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:选择题
向5 mL 0.1 mol·L-1 的KI溶液中滴加5~6滴0.1 mol·L-1 的FeCl3溶液后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是( )
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.再滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.再滴加KSCN溶液,观察是否有血红色
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上9月调考化学试卷(解析版) 题型:推断题
A、B、C、D、E、F为原子序数依次增大的六种元素。已知:A是周期表中原子半径最小的元素.B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子。
回答下列问题:
(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示)
(2)F在周期表中位于 区,与F同周期且未成对电子数最多的元素为 (填写元素符号),该元素价电子排布图为 ;
(3)B、E两种元素可形成BE3型化合物其化学式为 ,中心原子杂化方式为 ,分子的空间构型为 ;
(4)化合物BA3易溶解于化合物A2C中,其原因是 ;
(5)化合物DC熔点高于DE2的熔点,原因是 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第一次月考化学试卷(解析版) 题型:推断题
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
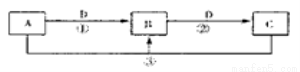
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ;工业上制取A的离子方程式为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为  。
。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是  。
。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com