
【题目】下列反应中产生气泡最快的是 ( )
温度 | 浓度 | 催化剂 | |
A | 25 ℃ | 2 mL 5% H2O2 | 0.1 mol·L-1 FeCl3 2滴 |
B | 35 ℃ | 2 mL 8% H2O2 | MnO2粉末 |
C | 25 ℃ | 2 mL 5% H2O2 | MnO2粉末 |
D | 25 ℃ | 2 mL 8% H2O2 | 无 |
A.AB.BC.CD.D
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A.元素周期表中有8个主族B.元素周期表中有7个周期
C.周期表中的主族都有金属元素D.IA族中的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小。下列能源中属于未来新能源的是 ( )
①天然气 ②煤 ③潮汐能 ④核能 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1mol/LNa2SO4溶液中含氧原子的数目一定大于4NA
B. 1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C. 生成1mol氧化产物时转移电子数为4NA
D. 通常状况下11.2LCO2中含质子的数目为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料是有机物的重要来源,从煤和石油获取的有机物苯和乙烯等简单有机物还是合成其他有机物的原料。如图的转化关系中,已知C能使碳酸钠溶液释放出CO2,反应①②反应机理类似且原子利用率均为100%,请回答下列问题:

(1)有机物A中含有的官能团名称是_________________。
(2)反应④的反应类型为_________________。
(3)请设计一种能验证B与C混合物中是否含物质B的实验方法_________________。
(4)下列说法正确的是_________________。
A.乙烯与氧气在催化剂作用下反应也可以生成C
B.纯C在16.6℃ 以下呈冰状固体
C.在制备D时,D中常混有一些挥发出来的反应物,可以通过加入NaOH溶液振荡再分液的方法提纯
D.石油裂解气通过净化和分离也能得到丙烯这样的短链烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确有( )个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶体数目为NA
⑤同温同压下,O2和CO组成的混合气体的密度是氢气的15倍,则O2和CO的体积比1:1
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧100克质量分数为46%的乙醇溶液中,含有的氧原子数目为4NA
⑨标准状况下,22.4LHF气体中含有NA个气体分子
A. 4 B. 1 C. 2 D. 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 200mL 含等物质的量 HBr 和H2SO3 的溶液中通入 0.01molCl2,有一半 Br-变为 Br2(已知 Br2 能氧化 H2SO3),原溶液中 HBr 和 H2SO3 的浓度都等于 :
A. 0.0075molL-1B. 0.0018mol L-1C. 0.04mol L-1D. 0.08molL L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
![]()
A. ![]() 、
、![]() 的晶体结构类型不同
的晶体结构类型不同
B. 加热硅、硫晶体使之熔化,克服的作用力不同
C. HCl、NaCl溶于水,破坏的化学键类型相同
D. NaOH、![]() 晶体中既有离子键又有共价键
晶体中既有离子键又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)。
2NH3(g)。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量。
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
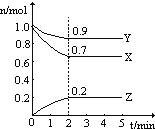
(1)该反应的化学方程式为_______________________。
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________。
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量 E.缩小容积
F.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将______。
a.延长 b.缩短 c.不变 d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com