
【题目】已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下面框图进行反应。
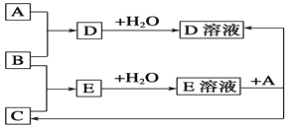
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是_________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的_______,理由是_________________________。
(3)如果E溶液是一种强酸,则E的化学式为_________。
【答案】③⑤A金属单质在室温下不是气态物质HCl
【解析】
A、B、C是中学化学中常见的单质,室温下A为固体,A可能为C、Si、S、常见的金属单质如Na、Mg、Al、Fe、Cu、Zn等;B和C均为气体,B、C可能为H2、N2、O2、Cl2等;化合物D、E溶于水分别得到D溶液、E溶液,“A+E溶液→C+D溶液”为置换反应,即固体单质在溶液中能置换出气体单质,根据置换反应的规律,C为H2,E为HCl,B为Cl2,A为金属单质;A与B、E溶液反应都生成D,则A为Na或Mg或Al或Zn,根据上述分析作答。
A、B、C是中学化学中常见的单质,室温下A为固体,A可能为C、Si、S、常见的金属单质如Na、Mg、Al、Fe、Cu、Zn等;B和C均为气体,B、C可能为H2、N2、O2、Cl2等;化合物D、E溶于水分别得到D溶液、E溶液,“A+E溶液→C+D溶液”为置换反应,即固体单质在溶液中能置换出气体单质,根据置换反应的规律,C为H2,E为HCl,B为Cl2,A为金属单质;A与B、E溶液反应都生成D,则A为Na或Mg或Al或Zn。
(1)A为Na或Mg或Al或Zn,B为Cl2,C为H2,A、B、C三种元素中的任意两种元素形成的化合物可能是氢化物、酸、盐;形成的化合物由两种元素组成,不可能为碱,因为没有O元素且化合物D、E溶于水分别得到D溶液、E溶液,不可能为氧化物;答案为:③⑤
(2)A、B、C三种元素中有一种是金属,这种元素是A、B、C中的A,因为金属单质在室温下不是气态物质。答案为:A 金属单质在室温下不是气态物质
(3)如果E溶液是一种强酸,E的化学式为HCl。答案为:HCl


科目:高中化学 来源: 题型:
【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论或解释 |
A | 向黄色的Fe(NO)3溶液中滴加氢碘酸,再加入一定量CCl4振荡并静置 | 下层溶液变为紫红色 | 氧化性:Fe3+>I2 |
B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中一定大量存在SO32- |
C | 向Mg2+和Cu2+共存的溶液中滴加适量 NaOH溶液,过滤、洗涤 | 得到白色沉淀 | 相同温度下,溶度积常数: Ksp[Mg(OH)2]< Ksp [Cu(OH)2] |
D | 一定温度下,向K2Cr2O7溶液中加入少量KOH溶液 | 溶液橙色变浅 | 减小H+浓度, Cr2O72-+H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g) +I2(g)![]() 2HI(g)中,每生成2 mol HI时会有a kJ 的能量放出,又知有关化学键键能如下:
2HI(g)中,每生成2 mol HI时会有a kJ 的能量放出,又知有关化学键键能如下:
![]()
下列说法正确的是
A. 1mol H2 的能量比2 mol H 的能量高
B. 将0.5 mol H2 与1mol I2(g)混合充分反应后放出的热量为0.5a kJ
C. H- I键的键能为0.5(a+b+c) kJ/mol
D. H +I![]() HI 是吸热变化
HI 是吸热变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.未洗涤烧杯和玻璃棒
B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥
D.定容时俯视液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的铜绿指的是( )
A. Cu2(OH)2CO3 B. Cu(OH)2 C. CuO D. Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阳极发生还原反应
C.精铜连接电源负极,其电极反应是Cu-2e-=Cu2+
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、Fe2O3和CuO混合物投入100 mL浓度2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,溶液中阳离子只有Fe2+,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为100 mL( )
A.2 mol/L B.1.8 mol/L C.1.9 mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知亚硫酸钠被氧化为硫酸钠,则铬元素在还原产物中的化合价为( )
A. +3价 B. +4价 C. +5价 D. +6价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com