
某同学想用实验证明高锰酸钾溶液的紫红色是MnO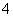 的颜色,而不是K+的颜色。他设计的实验步骤如下,你认为下述实验步骤一定没有意义的是( )
的颜色,而不是K+的颜色。他设计的实验步骤如下,你认为下述实验步骤一定没有意义的是( )
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置未见明显变化,表示锌与K+不反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO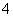 为紫红色
为紫红色
科目:高中化学 来源: 题型:
在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2+SO2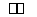 NO+SO3,平衡时,下列叙述正确的是( )
NO+SO3,平衡时,下列叙述正确的是( )
①NO和SO3的物质的量一定相等 ②NO2和SO2的物质的量一定相等 ③体系中的总物质的量一定等于反应开始时总物质的量 ④SO2、NO2、NO、SO3的物质的量一定相等
A.①和 ② B.②和③
② B.②和③
C.①和③ D.③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:① H2(g)+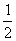 O2(g)=H2O(g)
O2(g)=H2O(g) △H=-241.8kJ·mol-1
△H=-241.8kJ·mol-1
② C(s)+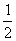 O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H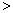 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
①在1300oC 时,该反应的平衡常数表达式K= 。5s内该反应的平均速率ν(N2) = (保留2 位有效数字);
位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
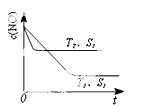
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g) 
 2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对可逆反应2X(g) + Y(g) 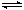 3Z(g) + W(s) ΔH>0
3Z(g) + W(s) ΔH>0
的叙述正确的是
A.加入少量W,逆反应速率增大,平衡向左移动
B.增大压强,正反应速率增大,逆反应速率减小
C.温度、体积不变,充入He气增大压强,反应速率会加快
D.升高温度,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的 密闭容器中,保持体系内温度800 ℃不变,将一定量的NO和O2混合发生反应:
密闭容器中,保持体系内温度800 ℃不变,将一定量的NO和O2混合发生反应:
2NO+O22NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示。请回答下列问题。
(1)30 s时反应达到平衡,用O2表示达到平衡过程的平均反应速率为
________,图像中曲线______ __(选填“Ⅰ”或“Ⅱ”)表示NO2的变化。由图像中曲线和数据变化,能否计算该温度下的平衡常数:____________(填“能”或“不能”)。
__(选填“Ⅰ”或“Ⅱ”)表示NO2的变化。由图像中曲线和数据变化,能否计算该温度下的平衡常数:____________(填“能”或“不能”)。
(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是________热反应(选填“吸”或“放”)。
(3)在800 ℃时,若缩小容器的体积,达新平衡时n(NO)________(选填“>”、“=”或“<”)0.07 mol,NO的转化率________(选填“增大”、“不变”或“减小”)。
(4)上述800 ℃时的反应达到平衡时测得放出热量a kJ。试写出在此条件下NO与氧气反应的热化学方程式________________________________________ __________________________。
__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
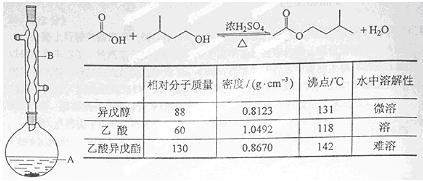
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)装置B的名称是:
(2)在洗涤操作中,第一次水洗的主要目的是: ; 第二次水洗的主要目的是: 。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:
(5)实验中加入少量无水硫酸镁的目的是: 
(6)在蒸馏操作中,仪器选择及安装都正确的是: (填标号)
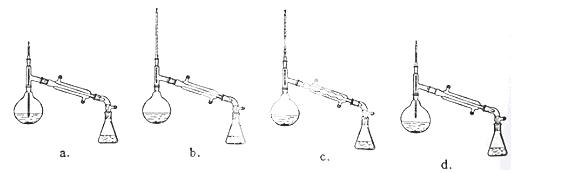
(7)本实验的产率是:
A、30℅ B、40℅ C、 50℅ D、60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或者低)原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
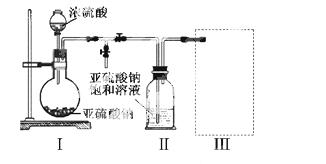
(1)装置I中产生气体的化学方程式为 。
(2)要从装置 II中获得已析出的晶体,可采取的分离方法是 。
II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是  。
。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算 )为 g·L-1。
)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是________。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他 们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
| 实验 | 酸或碱[ | 现象 |
| A | 1滴0.2 mol/L NaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1 mol/L硫酸 | 迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是____________________________
__________________________________________________。
写出在酸性条件下,MnO2氧化I-的离子方程式_____________________________
__________________________________________________。
(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1 g/cm3)配制浓度约为3%的H2O2溶液(密度近似为1 g/cm3)100 mL。其配制方法是:用量筒量取________mL 30% H2O2溶液放入________(填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2===2KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确________。
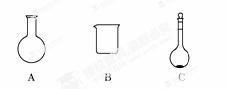
(5)实验室用二氧化锰和浓盐酸共热制取氯气,下列仪器可作为该反应的反应容器的是________(填序号)。
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH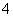 ===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列叙述正确的是
A.1 mol Cl2在反应中得到电子数不一定为2NA
B.1 mol O2在反应中得到电子数一定为4 NA
C.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
D.在2KClO3+4HC1(浓)= =2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com