
【题目】下列说法不正确的是( )
A.Na2CO3 比NaHCO3 的溶解度大
B.Na2CO3 比NaHCO3 稳定
C.物质的量相等的Na2CO3 和NaHCO3 , 前者质量大
D.物质的量相等的Na2CO3 和NaHCO3分别与足量盐酸反应得CO2 的物质的量之比为2:1
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是

A. 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B. 图②装置的盐桥中KCl的Cl-移向乙烧杯
C. 图③装置中钢闸门应与外接电源的负极相连获得保护
D. 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4 和K2SO4 的混合溶液中,如果c(Na+)=0.2mol/L,c(SO42﹣)=x mol/L,c(K+)=y mol/L,则x和y的关系是( )
A.x=0.5y
B.x=0.1+0.5y
C.y=2(x﹣0.1)
D.y=2x﹣0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为____________________。
(2)电负性最大的是_________________,第一电离能介于Y和Z之间的同周期元素有__________ (填元素符号)。
(3)Y和W的氯化物熔点高的是_________(填化学式),原因是____________________________;与Z的低价氯化物互为等电子体的离子是_____________。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是_____________________,分子中氮原子的杂化类型有_______________。
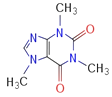
(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,试
确定该单元晶胞中含有______个WX,属于__________立方结构(填写面心、简单或体心),晶胞中距离W最近的X有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是 ( )
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为![]() ×100%
×100%
C. 将1 L该NaCl溶液蒸干可得到58.5c gNaCl固体
D. 20 ℃时,NaCl的溶解度S=![]() g
g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com