
【题目】某超市中一种电池外壳的纸层包装上印有如图所示的文字,根据要求回答:

(1)该电池的种类是______(填序号).
①干电池 ②蓄电池 ③燃料电池
(2)该电池含有的金属元素中,毒性最大的是______(写元素符号).
(3)该电池的使用和性能,下列说法中不正确的是______
A.该电池可应用于闹钟、收音机、照相机等
B.该电池可充电后反复使用
C.该电池使用后不能投入火中,应埋入地下以防污染环境
(4)已知该电池的总反应为:Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O,写出该电池放电时的正负极反应方程式:
负极___________________________________
正极___________________________________
【答案】 ① 汞 B C Zn – 2e = Zn2+ 2MnO2+ 2e +2NH4+=2NH3↑+Mn2O3+H2O
【解析】试题分析:由图中信息可知,该电池为锌锰干电池,不可充电或投入火中。其中汞含量小于0.025%,由于汞可以严重污染环境,故该电池不可随意丢弃,用后应回收处理。
(1)该电池的种类是干电池,填①.
(2)该电池含有的金属元素中,毒性最大的是汞.
(3)A.该电池可应用于闹钟、收音机、照相机等,A正确;B.该电池不可充电,是一次电池,B不正确; C.该电池使用后不能投入火中,不能埋入地下以防污染环境,C不正确。综上所述,关于该电池的使用和性能,以上说法中不正确的是B C。
(4)该电池的总反应为Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O,由总反应可知,Zn是负极,其发生氧化反应,其电极反应式为Zn – 2e = Zn2+,由总反应式和负极反应式可以写出正极的电极反应式为2MnO2+ 2e +2NH4+=2NH3↑+Mn2O3+H2O。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】下列为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
关于已知元素C、N、S和未知的元素X、Y、Z,回答下列问题:
(1)Z元素在周期表中的位置为______________。
(2)表中元素原子半径最大的是______________ (写元素符号)。
(3)①S与Z可形成化合物S2Z2,写出它的电子式______________。
②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,写出它的结构式______________。
(4)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体A、B均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________,生成硫酸铜物质的量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
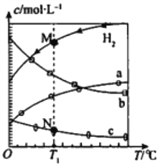
A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,是氧化还原反应的是( )
A. 2NaOH+H2SO4===Na2SO4+2H2O
B. FeO+H2SO4===FeSO4+H2O
C. BaCl2+H2SO4===BaSO4↓+2HCl
D. H2+CuO===Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA
B.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣数目为0.2NA
C.标准状况下,22.4LCHCl3含有的分子数为NA
D.1L 0.1molL﹣1的硫化钠溶液中硫离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时,存在以下反应:
①N2(g)+O2(g) ![]() 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
②2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
③4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) △H=____________kJ·mol-1。
2NH3(g) △H=____________kJ·mol-1。
(2)在恒温恒容容积为1 L的密闭容器中进行合成氨的反应,起始加入N2:1.0 mol、H2:3.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________。
②若其它条件不变增大压强,则合成氨反应的化学平衡常数_____________(填“变大”、“变小”或“不变”);
③经过2min达到化学平衡状态时测得H2的浓度为1.8mol/L,则平均化学反应速率v(NH3)_____________,氢气的转化率为________________。
④下图表示合成氨反应中H2 (g)的平衡转化率随温度的变化关系,判断P1_____P2(填“>”“ <”或“ = ”),并简述理由:__________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com