
| A. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| B. | 1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2 |
分析 A.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,溶液显碱性,X-离子水解程度大于HX电离程度;
B.1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中铜离子水解、铵根离子水解,铵根离子浓度大于铜离子浓度;
C.溶液中存在电荷守恒分析;
D.弱电解质浓度越小电离度越大,pH越大.
解答 解:A.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,溶液显碱性,X-离子水解程度大于HX电离程度,c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+),故A错误;
B.1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中铜离子水解、铵根离子水解,铵根离子浓度大于铜离子浓度,1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-),故B正确;
C.0.1mol•L-1NaHCO3溶液中电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),c(H2CO3 )>c(CO32-),c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-),故C正确;
D.溶液中存在电荷守恒分析D.弱电解质浓度越小电离度越大,pH越大,而c1α1=10-a,c2α2=10-a-1,α1<α2,所以c1>10 c2,故D正确;
故选A.
点评 本题考查了反应后溶液酸碱性判断、盐类水解、电解质溶液中电荷守恒、物料守恒、弱电解质电离平衡影响因素,题目难度中等.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体有丁达尔效应 | |
| B. | B、胶体粒子直径在1nm-100nm之间 | |
| C. | 胶体粒子很小,不受重力作用 | |
| D. | 同种胶体粒子带同种电荷,它们之间互相排斥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径为1.3×10-9m 的“钴酞菁”分子分散在水中能形成胶体,则该分子的直径比Na+大 | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 明矾净水利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
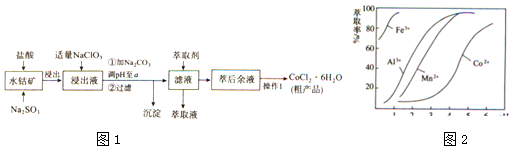
| 淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
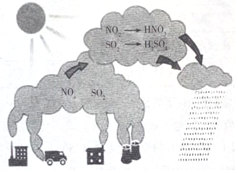
| A. | 图示过程表示了地球臭氧层的破坏过程 | |
| B. | 图中涉及的氧化物均为酸性氧化物 | |
| C. | 机动车尾气含有N的氧化产物 | |
| D. | 图示中描述的过程所涉及的反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
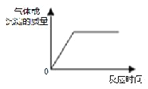
| A. | 向一定量铜片中加入过量浓硝酸 | |
| B. | .向一定量AlCl3溶液通入过量NH3 | |
| C. | .向一定量澄清石灰水中通入过量CO2 | |
| D. | .向一定量MgCl2溶液中滴加过量NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
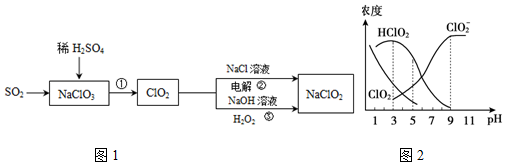
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可以消毒杀菌常用于净水 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 | |
| C. | 氢氧化铝在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com