
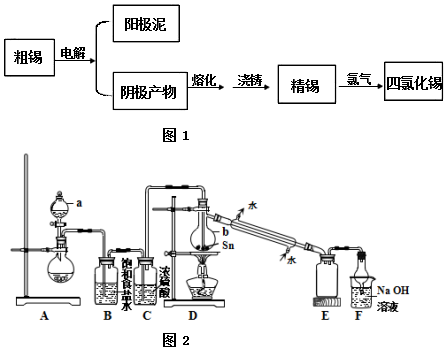
分析 电解粗锡,阳极反应为:Sn-2e-=Sn2+,不活泼的金属单质形成阳极泥,阴极反应为:Sn2++2e-=Sn,将阴极的Sn与氯气反应生成SnCl4,
(1)H2SiF6为强酸,与氧化亚锡生成相应的离子和水;硅氟酸能与二氧化硅反应,硅氟酸有腐蚀性,故不能选用含二氧化硅的玻璃电解槽和含有金属单质的不锈钢电解槽,可以选取塑料电解槽;电解池中阴极得电子发生还原反应;
(2)由装置图可知装置A应为制备氯气装置,无加热装置,可选用KMnO4或KClO3与浓盐酸制备氯气,装置B为饱和食盐水除去氯化氢气体,装置C为浓硫酸干燥氯气,氯气经除杂,干燥后与锡在装置D中反应生成SnCl4,经冷却后在装置E中收集,装置F吸收未反应完的氯气,因SnCl4极易水解,应防止空气中的水蒸气进入装置E中,以此解答该题.
解答 解:(1)H2SiF6为强酸,与氧化亚锡生成相应的离子和水,离子方程式为:2H++SnO=Sn2++H2O;硅氟酸能与二氧化硅反应,硅氟酸有腐蚀性,故不能选用含二氧化硅的玻璃电解槽和含有金属单质的不锈钢电解槽,可以选取塑料电解槽,选c;电解池中阴极得电子发生还原反应,反应式为:Sn2++2e-=Sn;
故答案为:2H++SnO=Sn2++H2O;c;Sn2++2e-=Sn;
(2)①由装置图可知装置A应为制备氯气装置,无加热装置,可选用KMnO4或KClO3与浓盐酸制备氯气,根据仪器构造可知仪器b为蒸馏烧瓶;
故答案为:KMnO4或KClO3;蒸馏烧瓶;
②反应需控制在一定温度范围之内,需要温度计;因SnCl4极易水解,应防止空气中的水蒸气进入装置中,故应在E与F之间缺加一个干燥装置;
故答案为:缺少温度计;E与F之间缺少干燥装置;
③SnCl4溶液中加入适量的NaOH溶液,产生白色沉淀(二元酸),白色沉淀H2SnO3,反应方程式为:Sn4++4OH-=H2SnO3↓+H2O;
故答案为:Sn4++4OH-=H2SnO3↓+H2O;
④用去锡粉5.95g,则n(Sn)=0.05mol,理论上产生的SnCl4的物质的质量是m(SnCl4)=0.05mol×261g/mol=13.05g所以反应后,若Ⅵ中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为$\frac{12.0g}{13.05g}$×100%=92.0%;
故答案为:92.0%.
点评 本题考查物质的制备,涉及电解池的原理仪器的识别、氯气的实验室制取方法、实验操作的目的、物质产率的计算等知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 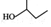 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H2Cl6 有4种同分异构体 | D. | C2H4和C4H8一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 提取碘水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度比水中大 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 纯碱的热稳定性大于碳酸氢铵 |
| C | 分离KNO3和NaCl | 重结晶 | 硝酸钾的溶解度大于氯化钠 |
| D | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯密度大于乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
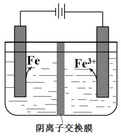
| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸:Fe2+、Cl-、NO3-、K+ | B. | 澄清溶液:MnO4-、S2-、Na+、H+ | ||
| C. | 食盐水:K+、NO3-、SO42-、Mg2+ | D. | pH=7的溶液:Na+、HCO3-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 光照条件下1mol CH4与3mol Cl2反应可制得1mol CHCl3 | |
| C. | 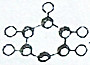 为苯分子的比例模型 为苯分子的比例模型 | |
| D. | HC≡C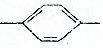 CH═CHCH3中所有碳原子有可能都在同一个平面内 CH═CHCH3中所有碳原子有可能都在同一个平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积比为8:11 | B. | 密度之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com