
| A. | 金刚石晶胞(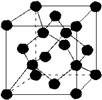 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 | |
| B. | 二氧化硅晶体中最小环上的氧原子数、氯化铯晶体中氯离子的配位数均为6 | |
| C. | 锌晶胞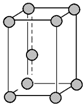 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 | |
| D. | 33g CH≡C-CH=CH-CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol. |
分析 A、根据晶胞的结构,利用均摊法计算各晶胞中所含有的原子数;
B、根据氯化铯晶胞的结构可知,氯离子的配位数为8;
C、根据锌晶胞结构可知,锌原子的配位数为12,氯化钠晶体中以晶胞顶点上的钠离子为例,距离该钠离子最近且相等的钠离子分布在晶胞的面心上,共有12个;
D、每个 CH≡C-CH=CH-CH3分子中所含的π键数为3,石墨中每个碳原子平均占有1.5mol碳碳键,据此计算;
解答 解:A、根据晶胞的结构,利用均摊法可知金刚石晶胞中含有碳原子数为4+$6×\frac{1}{2}+8×\frac{1}{8}$=8,碘晶体晶胞中平均含有碘分子数为$6×\frac{1}{2}+8×\frac{1}{8}$=4,所以晶胞中含有的原子数均为8,故A正确;
B、根据氯化铯晶胞的结构可知,氯离子的配位数为8,故B错误;
C、根据锌晶胞结构可知,锌原子的配位数为12,氯化钠晶体中以晶胞顶点上的钠离子为例,距离该钠离子最近且相等的钠离子分布在晶胞的面心上,共有12个,故C正确;
D、每个 CH≡C-CH=CH-CH3分子中所含的π键数为3,33g CH≡C-CH=CH-CH3的物质的量为0.5mol,含有π键为1.5mol,石墨中每个碳原子平均占有1.5mol碳碳键,12g石墨含有碳原子数为1mol,所以12g石墨中所含的碳碳键数均为1.5mol,故D正确;
故选B.
点评 本题主要考查常见晶胞的结构,学会运用均摊法进行计算,中等难度,答题时注意熟记常见晶胞的空间结构.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- | |
| B. | c(H+)=0.1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 在加入铝粉后能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
 .化合物丁存在的化学键类型是离子键、非极性共价键.
.化合物丁存在的化学键类型是离子键、非极性共价键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两 种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两 种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
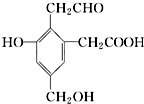 ,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的
,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的| A. | 6:4:5 | B. | 3:2:3 | C. | 3:2:2 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子晶体中不可能存在非极性键 | |
| B. | 在共价化合物的分子晶体中不可能存在离子键 | |
| C. | 在极性分子中不可能存在非极性键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com